
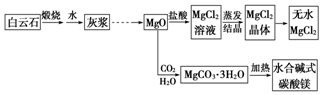
 碱式碳酸镁和无水氯化镁具有广泛的用途.用白云石(CaCO3•MgCO3)为主要原料生产碱式碳酸镁和无水氯化镁的流程如图:回答问题:
碱式碳酸镁和无水氯化镁具有广泛的用途.用白云石(CaCO3•MgCO3)为主要原料生产碱式碳酸镁和无水氯化镁的流程如图:回答问题:分析 白云石(CaCO3•MgCO3),煅烧生成CaO、MgO,CaO与水反应生成Ca(OH)2,灰浆过滤分离出MgO,MgO与盐酸反应生成氯化镁溶液,蒸发浓缩、冷却结晶得到晶体后加热得到无水氯化镁,MgO与水、二氧化碳反应生成•MgCO3.3H2O,再加热得到碱式碳酸镁,以此来解答.
解答 解:由流程可知CaCO3•MgCO3$\frac{\underline{\;高温\;}}{\;}$CaO+MgO+2CO2↑,CaO和水反应Ca(OH)2,而MgO不溶于水,“灰浆”中除水和MgO外,主要成分还有Ca(OH)2,
故答案为:Ca(OH)2.
点评 本题考查混合物分离提纯,为高频考点,把握流程中的反应、混合物分离方法为解答的关键,侧重分析与实验能力的考查,注意元素化合物与实验的结合,题目难度不大.


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:选择题
| X | Y | Z |
| W |
| A. | Z元素的常见化合价为:-1、-2 | |
| B. | X元素的氢化物的沸点一定比Z的低 | |
| C. | Y、Z、W形成的简单离子中,半径最小的是Z | |
| D. | Z元素的单质能从Na2W溶液中置换出W的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
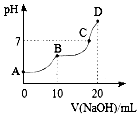 25℃时,向10mL 0.1mol•L-1 H2A溶液中滴加等浓度的NaOH溶液,溶液的pH与NaOH溶液的体积关系如图所示.下列叙述错误的是( )
25℃时,向10mL 0.1mol•L-1 H2A溶液中滴加等浓度的NaOH溶液,溶液的pH与NaOH溶液的体积关系如图所示.下列叙述错误的是( )| A. | C点溶液中含有NaHA和Na2A | |
| B. | NaHA溶液中水的电离程度比Na2A溶液中小 | |
| C. | B点,c (Na+)=2[c (H2A)+c (HA)+c (A2-)] | |
| D. | D点,c (Na+)>c (A2-)>c (OH-)>c (HA-)>c (H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤⑥ | B. | ②③④⑤ | C. | ①②③④⑥ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷中的任意三个原子都不共面 | |
| B. | CH2Cl2是纯净物说明甲烷是四面体结构而不是正方形结构 | |
| C. | 天然气、沼气、坑道气的主要成分均是甲烷 | |
| D. | 丙烷和甲烷一样能与氯气发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com