
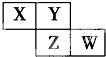
 X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )| A、原子半径:W>Z>Y>X |
| B、最高价氧化物对应水化物的酸性:Z>W>X |
| C、与H2化合,Z比W更容易 |
| D、形成的气态氢化物溶于水,溶液呈碱性的是:X |


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:
| A、200 mL 0.25 mol/L NaCl溶液 |
| B、200 mL 1 mol/L NaCl溶液 |
| C、100 mL 0.5 mol/L NaOH溶液 |
| D、100 mL 2 mol/L NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | ② | ③ | ④ | |
| 甲 | 常温常压下气体的质量 | 气体分子数 | 固体体积 | 溶液中溶质质量分数 |
| 乙 | 气体相对分子质量 | 阿伏加德罗常数 | 固体密度 | 溶液的体积 |
| A、①② | B、③④ | C、②③ | D、①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3CH2COOCH3 |
| B、CH3COOCH2CH3 |
| C、HCOOCH2CH2CH3 |
| D、HCOOCH(CH3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
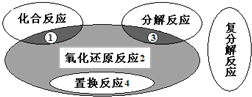
| A、Zn+H2SO4=ZnSO4+H2↑ | ||||
B、H2+Cl2
| ||||
C、2KClO3
| ||||
| D、2Cl2+2Ca (OH)2=CaCl2+Ca(ClO)2+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com