
下列叙述正确的是
A.乙酸与丙二酸互为同系物
B.不同元素的原子构成的分子只含极性共价键
C.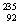 U和
U和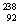 U是中子数不同质子数相同的同种核素
U是中子数不同质子数相同的同种核素
D.短周期第ⅣA与ⅦA族元素的原子间构成的分子,均满足原子最外层8电子结构
科目:高中化学 来源: 题型:
质量分数为n的硫酸溶液,其物质的量浓度a mol/L为,加热蒸发水使其质量分数变为2n,此时,该溶液中的物质的量浓度为b mol/L,则与的关系正确的是
A.b=2a B.a=2b C.b﹥2a D.b﹤2a
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏伽德罗常数的值。下列说法正确的是
A.高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3NA
B.室温下,1LpH=13的NaOH 溶液中,由水电离的OH-离子数目为0.1NA
溶液中,由水电离的OH-离子数目为0.1NA
C.氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA
D.5NH4NO3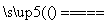 2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数目为3.75NA
查看答案和解析>>
科目:高中化学 来源: 题型:
取3.5 g某二价金属的单质投入50 g溶质质量分数为18.25%的稀盐酸中,反应结束后,金属仍有剩余;若取2.5 g该金属投入相同质量、相同质量分数的稀盐酸中,等反应结束后,加入该金属还可以反应。该金属的相对原子质量为 ( )
A.24 B.40 C.56 D.65
查看答案和解析>>
科目:高中化学 来源: 题型:
请订正下面的错误。
(1)硫在足量氧气中燃烧:2S+3O2===2SO3。
________________________________________________________________________。
(2)AlCl3溶液呈酸性的原因:Al3++3H2O===Al(OH)3↓+3H+。
________________________________________________________________________。
(3)NaOH溶液与稀硫酸反应的离子方程式:2H++2OH-===2H2O。
________________________________________________________________________。
(4)工业合成氨反应:N2+3H2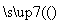 2NH3。
2NH3。
___________________________________ _____________________________________。
_____________________________________。
(5)工业上用氧化铝为原料制备金属铝:2Al2O3 4Al+3O2↑。
4Al+3O2↑。
________________________________________________________________________。
(6)NH4Cl溶液和NaOH溶液加热反应:NH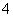 +OH-NH3·H2O。
+OH-NH3·H2O。
________________________________________________________________________。
(7)钢铁吸氧腐蚀,正极的电极反应:O2+2H2O===4OH-+4e-。
________________________________________________________________________。
(8)实验室制取氯气的离子方程式:MnO2+4HCl===MnCl2+Cl2↑+2H2O。
________________________________________________________________________。
(9)铜与浓硝酸反应:Cu+4HNO3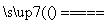 Cu(NO3)2+2NO2↑+2H2O。
Cu(NO3)2+2NO2↑+2H2O。
________________________________________________________________________。
(10)1 g肼气体燃烧生成氮气和水蒸气,放出热量16.7 kJ。反应的热化学方程式:
N2H4+O2===N2+2H2O ΔH=+16.7 kJ。
________________________________________________________________________。
(11)用惰性电极电解硫酸铜溶液的离子方程式
2Cu2++4OH-===2Cu+O2↑+2H2O。
________________________________________________________________________。
(12)Ba(OH)2溶液与稀硫酸反应的离子方程式:
Ba2++OH-+H++SO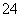 ===BaSO4↓+H2O。
===BaSO4↓+H2O。
________________________________________________________________________。
(13)铝—海水电池的负极反应式:Al-3e-+4OH-===[Al(OH)4]-。
________________________________________________________________________。
(14)碳酸氢钠在水中电离:NaHCO3 Na++H++CO
Na++H++CO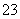 。
。
________________________________________________________________________。
(15)HCO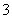 的水解方程式:HCO
的水解方程式:HCO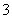 +H2O
+H2O H3O++CO
H3O++CO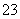 。
。
________________________________________________________________________。
(16)NaHSO4熔化时电离方程式:NaHSO4===Na++H++SO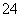 。
。
________________________________________________________________________。
(17)NH4Cl溶液呈酸性的原因:NH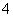 +H2O
+H2O NH4OH+H+。
NH4OH+H+。
________________________________________________________________________。
(18)铜与浓硫酸反应:Cu+2H2SO4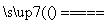 CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。
__________________________________________________________ ______________。
______________。
(19)NH4Cl固体和消石灰加热制NH3:2NH4Cl+Ca(OH)2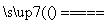 CaCl2+2NH3↑+H2O。
CaCl2+2NH3↑+H2O。
________________________________________________________________________。
(20)实验室制Cl2:4HCl(浓)+MnO2===MnCl2+Cl2↑+2H2O。
_______________________________________________________ _________________。
_________________。
(21)实验室利用H2O2分解制O2:2H2O2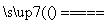 2H2O+O2↑。
2H2O+O2↑。
____ ____________________________________________________________________。
____________________________________________________________________。
(22)1 g氢气在足量氧气中燃烧生成液态水时,放出热量142.9 kJ,热化学方程式可表示为
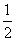 H2(g)+
H2(g)+ O2(g)
O2(g)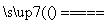
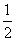 H2O(l) ΔH=-142.9 kJ。
H2O(l) ΔH=-142.9 kJ。
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学用语是学习化学的重要工具。下列用来表示物质变化的化学用语中正确的是
A.K37ClO3与浓HCl在加热条件下生成Cl2的化学方程式:
K37ClO3+6HCl=K37Cl+3Cl2↑+3H2O
B.表示H2燃烧热的热化学方程式: H2(g)+ O2(g)=H2O(g) △H= -241.8KJ/mol
O2(g)=H2O(g) △H= -241.8KJ/mol
C.将1~2ml FeCl3饱和溶液滴入到20ml沸水中所发生的离子方程式:
Fe3++3H2O Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+
D.电解氯化钠溶液: 2Cl—+2H+ Cl2↑+H2↑
Cl2↑+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
化学用语是学习化学的重要工具。下列用来表示物质变化的化学用语中,错误的是
A.钢铁腐蚀时可能发生的正极反应:2H2O + O2 + 4e- = 4OH-
B.表示H2燃烧热的热化学方程式:2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ/mol
C.纯碱水解的离子方程式:CO32- + H2O  HCO3- + OH-
HCO3- + OH-
D.Ca(HCO3)2溶液中加入过量澄清石灰水:Ca2++HCO3-+OH-=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
由熔盐电解法获得的粗铝含有一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用钢材镀铝。工艺流程如下:
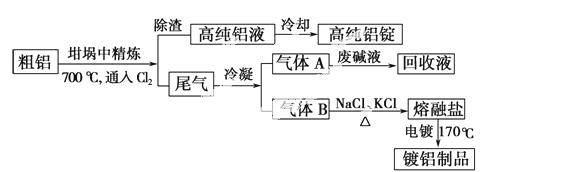
(注:NaCl熔点为801 ℃;AlCl3在181 ℃升华)
(1)精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,相关的化学方程式为①_____________和
②___________________。
(2)将Cl2连续通入坩埚中的粗铝熔体,杂质随气泡上浮除去。气泡的主要成分除Cl2外还含有_____________;
固态杂质粘附于气泡上,在熔体表面形成浮渣,浮渣中肯定存在________________。
(3)在用废碱液处理A的过程中,所发生反应的离子方程式为_____________。
(4)钢材镀铝后,表面形成的致密氧化铝膜能防止钢材腐蚀,其原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学是人类进步的关键,化学为人类的生产、生活提供了物质保证。
(1)电镀时,用镀层金属作阳极的作用是____________________________________。为了使镀层厚度均匀、光滑致密、与镀件的附着力22____。
(2)卤水中蕴含着丰富的镁资源,经转化后可获得MgCl2粗产品。从卤水中提取镁的步骤为
a.将海边大量存在的贝壳煅烧成石灰,并将石灰制成石灰乳;
b.将石灰乳加入到海水沉淀池中经过滤得到Mg(OH)2沉淀;
c.在Mg(OH)2沉淀中加入盐酸得到MgCl2溶液,再经蒸发结晶得到MgCl2·6H2O;
d.将MgCl2·6H2O在一定条件下加热得到无水MgCl2;
e.电解熔融的氯化镁可得到Mg。
①步骤d中的“一定条件”指的是__________________,目的是_________________。
②上述提取镁的流程中,为了降低成本,减少污染,可以采取很多措施,请写出其中一点________________________________________________________________________。
③有同学认为:步骤b后可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁,这样可简化实验步骤,你同意该同学的想法吗?为什么?
(3)铀是核反应最重要的燃料,已经研制成功一种螫合型离子交换树脂,它专门吸附海水中的U4+,而不吸附其他元素。其反应原理为____________________________________
________________________________________________________________________(树脂用HR代替),
发生离子交换后的离子交换膜用酸处理还可再生并得到含铀的溶液,其反应原理为________________________________________________________________________
________________________________________________________________________。
(4)阿司匹林(COOHOOCCH3) 在潮湿空气中可分解成水杨酸和醋酸而略带酸臭味,故密封保存,用化学方程式表示阿司匹林必须贮藏于密闭、干燥处的原因:______________
在潮湿空气中可分解成水杨酸和醋酸而略带酸臭味,故密封保存,用化学方程式表示阿司匹林必须贮藏于密闭、干燥处的原因:______________
________________________________________________________________________,
此反应的类型属于________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com