
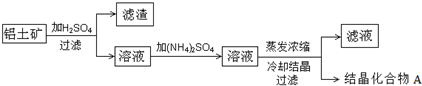
| ʵ�� | ʵ�鲽�� | ʵ���� |
| �� | ��ȡ9.06g�Ľᾧ������A���� | ���ȵ������㶨ʱ������������4.32g�� |
| �� | �����Ⱥ����õĹ���ֳ����ȷݣ��ֱ��������ˮ���Ƴ���Һ�� | |
| �� | ��һ����Һ�м���������BaCl2��Һ�� | ����4.66g ��ɫ������ |
| �� | ����һ����Һ�У���μ���2mol•L-1��NaOH��Һ�� | �ȹ۲쵽������ɫ���������Ų����д̼�����ζ������B���������ܽ⣬������25mL������������Һʱ������ǡ����ȫ�ܽ⣮ |
���� ��1����������������ܽ⣬�������ܽ�������������ˮ���������������ܽ�������������ˮ�����˵õ���Һ�м����������Һ������Ũ����ȴ�ᾧ���˵õ��õ��ᾧ������A��������A��һ�ְ�ɫ�����壬��������ˮ��ˮ��Һ�����ԣ�
��2����ȡ9.06g�Ľᾧ������A���ȣ����ȵ������㶨ʱ������������4.32gΪ�ᾧˮ��������n��H2O��=$\frac{4.32g}{18g/mol}$=0.24mol�������Ⱥ����õĹ���ֳ����ȷݣ��ֱ��������ˮ���Ƴ���Һ����һ����Һ�м���������BaCl2��Һ������4.66g ��ɫ����Ϊ���ᱵ�����ʵ���n��BaSO4��=$\frac{4.66g}{233g/mol}$=0.02mol������һ����Һ�У���μ���2mol•L-1��NaOH��Һ���ȹ۲쵽������ɫ����Ϊ����������Al3++3OH-=Al��OH��3�������Ų����д̼�����ζ������BΪNH3���ж�A�к�NH4+��NH4++OH-=NH3��+H2O���������ܽ⣬������25mL������������Һʱ������ǡ����ȫ�ܽ������������ܽ�����NaAlO2��Al��OH��3+OH-=AlO2-+2H2O���������������������ʵ���=0.025L��2mol/L=0.5mol����ÿ��A�к�Al3+���ʵ���Ϊx����笠��������ʵ���Ϊy��9.06g�Ľᾧ������A�к�笠����Ӻ�����������=9.06g-0.02mol��2��96g/mol-4.32g=0.9g��ÿ�ݺ�笠����Ӻ�����������Ϊ0.45g���������ʵ�����ϵ��������ϵ��ʽ����õ�A�Ļ�ѧʽ��
��1����������������Ҫ��Ӧ�������ܽ�������������ˮ���������������ܽ�������������ˮ��
��2�����������������㣻
��3��A������ˮ����ԭ������Һ��������ˮ����������������������������������ʵ����ã�
��4����ȼ�ϵ���и����ǰ����ڼ�����Һ��ʧ�������ɵ�����ˮ��
��� �⣺��1����������������Ҫ��Ӧ�������ܽ�������������ˮ����Ӧ�����ӷ���ʽΪ��Al2O3+6H+=2Al3++3H2O���������������ܽ�������������ˮ����Ӧ�����ӷ���ʽΪ��Fe2O3+6H+=2Fe3++3H2O��
�ʴ�Ϊ��Al2O3+6H+=2Al3++3H2O�� Fe2O3+6H+=2Fe3++3H2O��
��2����ȡ9.06g�Ľᾧ������A���ȣ����ȵ������㶨ʱ������������4.32gΪ�ᾧˮ��������n��H2O��=$\frac{4.32g}{18g/mol}$=0.24mol�������Ⱥ����õĹ���ֳ����ȷݣ��ֱ��������ˮ���Ƴ���Һ����һ����Һ�м���������BaCl2��Һ������4.66g ��ɫ����Ϊ���ᱵ�����ʵ���n��BaSO4��=$\frac{4.66g}{233g/mol}$=0.02mol������һ����Һ�У���μ���2mol•L-1��NaOH��Һ���ȹ۲쵽������ɫ����Ϊ����������Al3++3OH-=Al��OH��3�������Ų����д̼�����ζ������BΪNH3���ж�A�к�NH4+��NH4++OH-=NH3��+H2O���������ܽ⣬������25mL������������Һʱ������ǡ����ȫ�ܽ������������ܽ�����NaAlO2��Al��OH��3+OH-=AlO2-+2H2O���������������������ʵ���=0.025L��2mol/L=0.05mol����ÿ��A�к�Al3+���ʵ���Ϊx����笠��������ʵ���Ϊy��9.06g�Ľᾧ������A�к�笠����Ӻ�����������=9.06g-0.02mol��2��96g/mol-4.32g=0.9g��ÿ�ݺ�笠����Ӻ�����������Ϊ0.45g��
��4x+y=0.05mol
27x+18y=0.45g
x=0.01mol
y=0.01mol
ÿ�ݺ�笠��������ʵ���Ϊ0.01mol�����������ʵ���Ϊ0.01mol��������������ʵ���Ϊ0.02mol��ˮ���ʵ���Ϊ0.12mol��
n��NH4+����n��Al3+����n��SO42-����n��H2O��=0.01��0.01��0.02��0.12=1��1��2��12
��ѧʽΪ��NH4Al��SO4��2•12H2O��
�ʴ�Ϊ��NH4Al��SO4��2•12H2O��
��3��A������ˮ����ԭ������Һ��������ˮ����������������������������������ʵ����ã���Ӧ�����ӷ���ʽΪ��Al3++3H2O?Al��OH��3�����壩+3H+��
�ʴ�Ϊ��Al3++3H2O?Al��OH��3�����壩+3H+��
��4������B�����������ȼ�ϵ�أ������ȶ��ĵ��ʺ�ˮ����KOHΪ����ʣ���ȼ�ϵ���и����ǰ����ڼ�����Һ��ʧ�������ɵ�����ˮ����ⷴӦΪ��2NH3-6e-+6OH-=N2+6H2O��
�ʴ�Ϊ��2NH3-6e-+6OH-=N2+6H2O��
���� ���⿼����������ɡ�ʵ��ⶨ��ѧʽ�Ĺ��̺ͼ��㡢����ˮ�⡢ԭ���ԭ����֪ʶ�㣬���ջ����ǽ���ؼ�����Ŀ�Ѷ��еȣ�


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1 Lˮ�к���1 mol NaCl | |
| B�� | ��Һ�к���1 mol NaCl | |
| C�� | 1 L��Һ�к���1 molNaCl | |
| D�� | ��58.5 g NaCl����1 Lˮ�����õ���Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ���ٴ���4������ | |
| B�� | Cl-һ�����ڣ���c��Cl ����0.4 mol/L | |
| C�� | SO42-��NH4+��һ�����ڣ�Cl-���ܲ����� | |
| D�� | CO32-��Al3+һ�������ڣ�K+���ܴ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
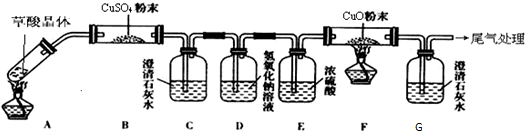
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����������Σ������ڼ���Թ����ƿ��Ա�����ĥ�ڲ������Լ�ƿ�� | |
| B�� | ��Ӧ��Na2SiO3+H2O+CO2�TNa2CO3+H2SiO3������Ӧ��Na2CO3+SiO2$\frac{\underline{\;����\;}}{\;}$NaSiO3+CO2��������Ӧ���ì�ܵģ������ܶ����� | |
| C�� | ��ͨ������ʯӢ������ˮ��Ⱦ����ڹ����β��� | |
| D�� | ��ĸ�̵���Ҫ�ɷ�ΪBe3Al2Si6O18������������ʽ��ʾΪ3BeO•Al2O3•6SiO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������ڢ�A�� | B�� | �������ڢ�A�� | C�� | �������ڢ�B�� | D�� | �������ڢ�B�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
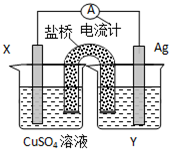 ����������ԭ��Ӧ��2Ag+��aq��+Cu��s���TCu2+��aq��+2Ag��s����Ƶ�ԭ�����ͼ��ʾ��
����������ԭ��Ӧ��2Ag+��aq��+Cu��s���TCu2+��aq��+2Ag��s����Ƶ�ԭ�����ͼ��ʾ���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com