
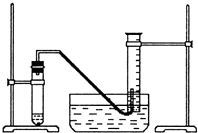
 某学生利用锌与稀硫酸反应产生的氢气的体积,粗略测定锌的摩尔质量(设Wg锌片全部反应,产生气体的体积折算成标准状况时不超过50mL).实验装置如下:
某学生利用锌与稀硫酸反应产生的氢气的体积,粗略测定锌的摩尔质量(设Wg锌片全部反应,产生气体的体积折算成标准状况时不超过50mL).实验装置如下:分析 (1)检查气密性的方法:将导管的出口放入水中,用手紧握试管,观察水中的导管口是否有气泡冒出;
(2)要准确测量气体体积必须保持量筒内外气体的温度和压强相等,因此在读取量筒内气体的体积之前,应使试管和量筒内的气体都冷却至室温;再调节量筒内外液面高度使之相同;
(3)观察装置图可知,量筒内液面高于水槽液面,只要将量筒慢慢下移即可;使量筒内气体压强等于大气压;
(4)利用氢气的体积计算消耗锌的物质的量,再根据摩尔质量=$\frac{m}{n}$计算.
解答 解:(1)检验装置的气密性时,将导管的出口浸入水槽的水中,手握住试管,有气泡从导管口逸出,放开手后,有少量水进入导管,表明装置不漏气.
故答案为:将导管的出口浸入水槽的水中,手握住试管,有气泡从导管口逸出,放开手后,有少量水进入导管,表明装置不漏气;
(2)因为排出的气体是需要用排出的水的体积衡量的,而反应前后的量筒温度是不同的,因此,反应终止应该先停止加热,待体系恢复到室温时,才取出导管.这一步操作跟通常的实验不同,所以停止加热时导管的出口要高于量筒内的液面,此时即使不取出导管而停止加热,也不会造成水的倒吸;停止加热、回到室温后,将量筒下移以调节量筒内的液面与水槽一致,此时量筒内气体压强也为大气压,读数才是正确的;所以正确的操作顺序为:b使气体都冷却至室温;a调整量筒内外液面高度使之相同;c读取量筒内气体的体积;即bac;
故答案为:bac;
(3)由于测气体体积时必须使内外压强相等,故需调节量筒高度,使其中的液面与试管液面水平;
故答案为:缓缓将量筒下移,使量筒内外液面相平;使量筒内气体压强等于大气压;
(4)锌和稀硫酸反应的关系可知反应的锌的物质的量和生成氢气标准状况下气体物质的量相同,实验中测得粗锌质量为W g,得到的氢气体积是V mL(已折算成标准状况),水蒸气的影响忽略不计,氢气的物质的量为:$\frac{VL×10{\;}^{-3}}{22.4L/mol}$,即消耗锌的物质的量为:$\frac{VL×10{\;}^{-3}}{22.4L/mol}$,故锌的摩尔质量=$\frac{m}{n}$=$\frac{Wg}{\frac{VL×10{\;}^{-3}}{22.4L/mol}}$=$\frac{22400W}{V}$g/mol,
故答案为:$\frac{22400W}{V}$g/mol.
点评 本题较全面的考查化学实验双基知识.包括的考点有实验的操作、原理、数据的采用和处理,利用常用的中学仪器做定量实验,题目难度中等.注意气密性的检查和量气操作.


科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡溶液与硫酸混合:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| B. | 铁粉与硝酸银溶液反应:Fe+2Ag+═Fe2++2Ag | |
| C. | 氯化铝溶液与过量的氨水反应:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 氯气通入冷的氢氧化钠溶液中:Cl2+2OH-═Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
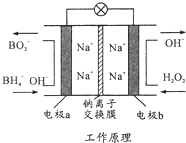 某新型电池,以NaBH4(B的化合价为+3价)和H2O2做原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法正确的是( )
某新型电池,以NaBH4(B的化合价为+3价)和H2O2做原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法正确的是( )| A. | 电池工作时Na+从b极区移向a极区 | |
| B. | a极上的电极反应式为BH4-+8OH--8e-=BO2- | |
| C. | b极上的电极反应式为H2O2+2e-+2H+=2H2O | |
| D. | 每消耗3molH2O2,转移3mol e- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 碳酸氢铵和足量的氢氧化钠溶液反应:NH4++OH-=NH3↑+H2O | |
| B. | 三氯化铁溶液中通入硫化氢气体:2Fe3++H2S=2Fe2++S↓+2H+ | |
| C. | 用稀硝酸浸泡做过银镜反应的试管:Ag+2H++NO3-=Ag++NO2↑+H2O | |
| D. | 偏铝酸钠溶液中通入过量的二氧化碳气体:2AlO2-+CO2+2H2O=2Al(OH)3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol•L-1 | 1 | 6 | 4 | x |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)<c(OH-)<c(CH3COO-)<c(Na+) | B. | c(H+)<c(OH-)<c(Na+)<c(CH3COO-) | ||
| C. | c(H+)<c(CH3COO-)<c(OH-)<c(Na+) | D. | c(OH-)<c(CH3COO-)<c(H+)<c(Na+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com