
“活化分子”是衡量化学反应速率快慢的重要依据,下列对“活化分子”的说法不正确的是( )
A. 活化分子之间的碰撞一定是有效碰撞
B. 增大反应物的浓度,可使单位体积内活化分子增多,反应速率加快
C. 对于有气体参加的反应增大压强,可使单位体积内活化分子增多,反应速率加快
D. 催化剂能降低反应的活化能,使单位体积内活化分子百分数大大增加
科目:高中化学 来源:2016-2017学年甘肃省嘉峪关市高一上学期期末考试化学试卷(解析版) 题型:推断题
已知A、B、C、D为气体,E、F为固体,G是氯化钙,它们之间的转化关系如下 图所示:

(1)、B在A中燃烧的实验现象为___________,其化学方程式为_____________。
(2)、实验室可用C的浓溶液与一种黑色粉末反应制取A,该反应的离子方程式______________,若反应中转移0.5 mol电子,则生成A的体积(标准状况)为__________L,被氧化的C的物质的量为_________mol。
(3)、E和F反应生成D、H和G的化学方程式为______________,实验室可通过多种方法制备D,用下图所示装置收集D,下列关于制取及收集D实验的叙述正确的是______________(填序号)。

①D气体不能用排水法收集
②实验室用E一种药品可以制取D
③右图中的a为浸有稀H2SO4的棉花
④可用D的浓溶液和生石灰为原料制取D
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省新余市高二下学期入学考试化学试卷(解析版) 题型:选择题
常温下,pH=12的氢氧化钠溶液和pH=4的醋酸溶液等体积混合后恰好中和,忽略混合后溶液体积的变化,下列说法中正确的是( )
A. 混合后的溶液中c(Na+)=c(CH3COO-)
B. 混合前的醋酸约1%发生电离
C. 氢氧化钠和醋酸的浓度不相等
D. 混合后的溶液呈中性
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省大同市高二2月月考化学试卷(解析版) 题型:选择题
2008年10月8日,美籍华裔科学家钱永健获得2008年度诺贝尔化学奖。16岁时,他凭借一个金属易受硫氰酸盐腐蚀的调查项目,荣获“美国西屋科学天才奖”。下列叙述正确的是( )
A. 金属腐蚀就是金属失去电子被还原的过程
B. 合金的熔点都高于它的成分金属,合金的耐腐蚀性也都比其成分金属强
C. 铜板上的铁铆钉处在潮湿的空气中直接发生反应:Fe-3e-= Fe3+,继而形成铁锈
D. 将水库中的水闸(钢板)与外加直流电源的负极相连,正极连接到一块废铁上可防止水闸被腐蚀
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省大同市高二2月月考化学试卷(解析版) 题型:选择题
在一体积可变的容器中,当反应2HI(g)  H2(g)+I2(g) 达到平衡时,欲使混合气体的颜色加深,采取的措施不能达到此目的是( )
H2(g)+I2(g) 达到平衡时,欲使混合气体的颜色加深,采取的措施不能达到此目的是( )
A. 恒容下充入HI(g) B. 恒容下充入H2(g) C. 恒容下充入I2(g) D. 减小容器体积
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省葫芦岛市高一下学期选拔考试化学试卷(解析版) 题型:推断题
物质A~M在一定条件下的转化关系如图(部分产物及反应条件未列出).其中,I是既能与强酸反应生成氢气又能与强碱反应生成氢气的金属,K是一种红棕色气体,D的俗名叫铁红,A是形成酸雨的主要气体.

请填写下列空白:
(1)推导出下列物质的化学式:C:_____E:_____
(2)在反应②、③、⑥、⑨中,既属于化合反应又属于非氧化还原反应的是_______________(填写序号).
(3)反应④的离子方程式是:______________________.
(4)将化合物D 与KNO3、KOH 共融,可制得一种“绿色”环保高效净水剂K2FeO4 (高铁酸钾),同时还生成KNO2和H2O.该反应的化学方程式是:_______________________.
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省葫芦岛市高一下学期选拔考试化学试卷(解析版) 题型:选择题
现有1.92g铜投入一定量的浓硝酸中,铜完全溶解,生成的气体颜色越来越浅,共收集到标准状况下的气体672mL,将盛有该气体的容器倒扣在水中,通入标准状况下一定体积的氧气,恰好使气体完全溶于水中,则通入氧气的体积是( )
A. 168mL B. 224mL C. 504mL D. 336mL
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三下学期期初考试化学试卷(解析版) 题型:选择题
已知:CO(g)+H2O(g) CO2(g)+H2(g) △H=-41kJ•mol-1相同温度下,在体积相同的两个恒温密闭容器中,加入一定量的反应物发生反应.相关数据如下:
CO2(g)+H2(g) △H=-41kJ•mol-1相同温度下,在体积相同的两个恒温密闭容器中,加入一定量的反应物发生反应.相关数据如下:
容器编号 | 起始时各物质物质的量/mol | 达平衡过程体系能量的变化 | |||
CO | H2O | CO2 | H2 | ||
① | 1 | 4 | 0 | 0 | 放出热量:32.8 kJ |
② | 0 | 0 | 1 | 4 | 热量变化:Q |
下列说法中正确的是
A. 容器①中反应达平衡时,CO的转化率为80%
B. 平衡时,若向容器①中再加入0.2molCO和0.2molCO2,则V正<V逆
C. Q=8.2
D. 容器①中CO的转化率与容器②中CO2的转化率之和为1
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三下学期开学考试化学试卷(解析版) 题型:选择题
下列实验装置应用于铜与浓硫酸反应制取二氧化硫和硫酸铜晶体,能达到实验目的的是( )
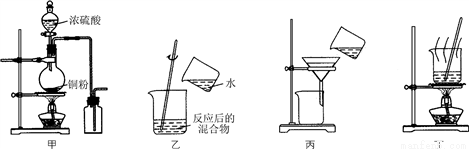
A. 用图甲装置制取并收集二氧化硫
B. 用图乙装置向反应后的混合物中加水稀释
C. 用图丙装置过滤出稀释后混合物中的不溶物
D. 用图丁装置将硫酸铜溶液蒸发浓缩后冷却结晶
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com