
某学生对碱性工业废水样品进行研究,其实验操作或结论的描述,正确的是( )
A.将废水加入紫色石蕊试剂中检验酸碱性
B.用玻璃棒蘸取废水样品,蘸在润湿的pH试纸上测定其pH
C.测得该废水样品的pH=10,则废水样品中c(OH-)=10-10mol/L
D.该工业废水中c(H+)<c(OH-)
科目:高中化学 来源:2016届黑龙江哈尔滨六中高三下三模理综化学试卷(解析版) 题型:填空题
甲醇作为基本的有机化工产品和环保动力燃料具有广阔的应用前景,二氧化碳加氢合成甲醇是合理利用二氧化碳的有效途径。由二氧化碳制备甲醇过程中可能涉及反应如下:
反应Ⅰ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.58KJ/mol
CH3OH(g)+H2O(g) △H1=-49.58KJ/mol
反应Ⅱ:CO2(g)+H2(g) CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g) CH3OH(g) △H3=-90.77KJ/mol
CH3OH(g) △H3=-90.77KJ/mol
回答下列问题:
(1)反应Ⅱ的△H2= ,反应Ⅲ自发进行条件是 (填“较低温”、“较高温”或“任意温度”)。
(2)在一定条件下3L恒容密闭容器中,充入一定量的H2和CO2仅发生反应Ⅰ,实验测得反应物在不同起始投入量下,体系中二氧化碳的平衡转化率与温度的关系曲线,如图1所示。

①氢气和二氧化碳的起始投入量以A和B两种方式投入:
A:n(H2)=3mol n(CO2)=1.5mol
B:n(H2)=3mol n(CO2)=2mol,
曲线Ⅰ代表哪种投入方式 (用A、B表示)
②在温度为500K的条件下,按照A方式充入3mol氢气和1.5mol二氧化碳,该反应10min后达到平衡:此温度下的平衡常数为 ;500K时,若在此容器中开始充入0.3mol氢气和0.9mol二氧化碳、0.6mol甲醇、xmol水蒸气,若使反应在开始时正向进行,则 x 应满足的条件是 。
(3)在恒温恒压密闭容器中,充入一定量的H2和CO2(假定仅发生反应I),反应过程中,能判断反应I已达到平衡状态的标志是
A.断裂3molH-H键,同时有3molH-O键形成
B.容器内的压强保持不变
C.容器中气体的平均摩尔质量不变
D.容器中气体的密度保持不变
(4)以甲醇、氧气为原料,100mL 0.15mol/LNaOH溶液为电解质设计成燃料电池,若放电时参与反应的氧气体积为336mL(标况)产生的气体全部被NaOH溶液吸收,则所得溶液中溶质的成分及物质的量之比为 ,溶液中各离子浓度由大到小的顺序 。
查看答案和解析>>
科目:高中化学 来源:2016届海南省高三临考模拟化学试卷(解析版) 题型:选择题
在密闭容器中存在下列平衡:CO(g)+H2O(g) CO2(g)+H2(g);CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如下图所示。下列说法正确的是
CO2(g)+H2(g);CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如下图所示。下列说法正确的是

A.平衡状态A与C相比,平衡状态A的c(CO)小
B.在T2时,若反应处于状态D,则一定有V正<V逆
C.反应CO(g)+H2O(g) CO2(g)+H2(g)的ΔH<0
CO2(g)+H2(g)的ΔH<0
D.若T1、T2时的平衡常数分别为K1、K2,则K1<K2
查看答案和解析>>
科目:高中化学 来源:2016届海南省高三考前预测化学试卷(解析版) 题型:推断题
A、B和C为短周期非金属元素,原子序数依次减小,A的最低负化合价为-2,无最高正价,B是空气中含量最高的元素,C最外层电子数与电子层数相等。回答下列问题:
(1)A、B和C分别为__________、____________、_____________(用元素名称表示)。
(2)由以上元素组成的化合物中,属于离子化合物的是___________,属于共价化合物的是_________。(各写一种即可)
(3)B的常见气态氢化物的电子式为_______________,B的常见气态氢化物与其最高价氧化物对应的水化物反应产物的阳离子含有____________(填化学键的种类),该离子氯化物的水溶液呈__________性,用离子方程式表示为_______________________。
查看答案和解析>>
科目:高中化学 来源:2016届海南省高三考前预测化学试卷(解析版) 题型:选择题
下列事实中,能说明B(OH)2是弱碱的是( )
A.等体积的0.010mol/LB(OH)2溶液与0.010mol/LH2SO4溶液恰好完全反应
B.0.010mol/LB(OH)2溶液能使红色石蕊试液变蓝
C.0.010mol/LBCl2溶液呈酸性,0.010mol/LB2CO3溶液呈中性
D.0.010mol/LB(OH)2溶液能够与NH4Cl反应生成NH3(g)
查看答案和解析>>
科目:高中化学 来源:2016届贵州省高三第八次月考理综化学试卷(解析版) 题型:填空题
碳和氮是重要的非金属元素,向大气中过度排放二氧化碳会造成温室效应,氮氧化物会产生光化学烟雾,研究含氮、碳化合物的性质对它们的综合利用有重要意义。
(1)NOx是形成光化学烟雾的主要物质,反应NO+O3=NO2+O2,若生成11.2L O2(标准状况)时,转移电子的物质的量是__________。
(2)硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:NO2(g)+SO2(g) SO3(g)+NO(g)△H=-41.8kJ•mol-1
SO3(g)+NO(g)△H=-41.8kJ•mol-1
已知:2SO2(g)+O2(g) 2SO3(g)△H=-196.6kJ•mol-1
2SO3(g)△H=-196.6kJ•mol-1
写出NO和O2反应生成NO2的热化学方程式__________;
(3)N2H4(肼或联氨)燃料电池(产生稳定、无污染的物质)原理如图1所示.M电极发生的电极反应式为__________;
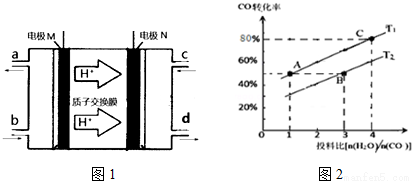
(4)已知CO(g)+H2O(g)__________H2(g)+CO2 (g)△H>0
①一定条件下反应达到平衡状态后,若改变反应的某个条件,下列变化能说明平衡一定向正反应方向移动的是__________(填写字母)
A.逆反应速率先增大后减小
B.H2O(g)的体积百分含量减小
C.CO的转化率增大
D.容器中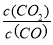 的值减小
的值减小
②在某压强下,上述反应在不同温度、不同投料比时,CO的转化率如图2所示.则KA、KB、KC三者之间的大小关系为__________。
③T1温度下,将1molCO和4mol H2O (g)充入2L的密闭容器中,5min后反应达到平衡状态,则0~5min内的平均反应速率v(CO)=__________;若保持其他条件不变,向平衡体系中再通入1molCO和1molCO2,此时v(正)__________v(逆)(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源:2016届贵州省高三第八次月考理综化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值.下列说法正确的是( )
A.1.6gNH2-和1.5g—CH3含有的电子数均为NA
B.标准状况下,将2.24L 氯化氢溶于足量水中,溶液中含有的HCl分子数为0.1NA
C.氢氧化钠溶于与氯气反应时,生成0.1molNaCl转移的电子数为0.1NA
D.12gNaHSO4晶体中阳离子和阴离子的总数为0.3NA
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省高二5月月考化学试卷(解析版) 题型:填空题
硫酸铜晶体,俗称蓝矾、胆矾,具有催吐,祛腐,解毒。取5.0 g胆矾样品逐渐升高温度使其分解,分解过程的热重如下表。回答下列问题:
温度范围/℃ | 固体质量/g |
258~680 | 3.20 |
680~1000 | 1.60 |
1000以上 | 1.44 |
(1)测定蓝矾属于晶体的物理方法是____________。其中SO42-中S原子的轨道杂化形式是____________;H2O的空间构型是__________________。
(2)将硫酸铜晶体加热到258~680℃生成的物质A,A是__________(化学式);A溶于水配成溶液,加入氨水,观察到的现象是_____________________________________________;最终得到溶液中的含铜元素的离子是_________________(化学式),该离子含有的化学键类型有___________________。
(3)将硫酸铜晶体加热到1000℃以上生成的物质C,在C中的铜的离子的基态电子排布式是____________;
(4)如图是硫酸铜晶体分解得到一定温度的产物的晶胞(白球和黑球代表不同的原子)。

①该温度是_______________。
②铜原子的配位数是_______________。
③已知该晶体的密度为dg·cm-3,则晶胞参数是_________________pm。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省汕头市高二下期末化学试卷(解析版) 题型:选择题
桂皮酸、布洛芬和阿司匹林均为某些药物的有效成分,其结构简式如下:

以下关于这三种有机物的说法中,不正确的是
A.都能与Na2CO3溶液反应产生CO2
B.一定条件下,均能与乙醇发生取代反应
C.只有桂皮酸可与溴的四氯化碳溶液发生加成反应
D.1mol阿司匹林最多能与2mol NaOH反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com