
反应A(g)+B(g) C(g)+D(g)发生过程中的能量变化如图,△H 表示反应的焓变。
C(g)+D(g)发生过程中的能量变化如图,△H 表示反应的焓变。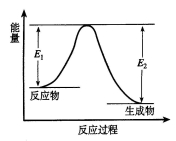
下列说法正确的是
A.反应体系中加入催化剂,反应速率增大,E1减小,E2增大
B.反应体系中加入催化剂,反应速率增大,△H不变
C.△H<0,反应达到平衡时,升高温度,A的转化率增大
D.△H>0,反应达到平衡时,升高温度,A的转化率减少
科目:高中化学 来源:2015届浙江省高三上学期第二次质量检测化学试卷(解析版) 题型:填空题
铜合金是人类使用最早的金属材料,铜在化合物中的常见化合价有+l 、+2。已知Cu2O与稀硫酸反应,有红色金属析出且溶液呈蓝色。现向Cu、Cu2O和CuO组成的混合物中,加入1 L 0.6 mol/L HNO3溶液恰好使混合物溶解,同时收集到2240 mL NO气体(标准状况)。请回答下列问题:
(1)写出Cu2O跟稀硝酸反应的离子方程式 。
(2)若将上述混合物用足量的H2加热还原,所得到固体的质量为 。
(3)若混合物中含0.1 mol Cu,将该混合物与稀硫酸充分反应,至少消耗H2SO4的物质的量为 。
(4)若混合物中Cu的物质的量为n mol,则n的取值范围为 。
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期第一次统练化学试卷(解析版) 题型:选择题
下列是卤素单质(F2、Cl2、Br2、I2)的沸点与相对分子质量的关系图,下列说法错误的是

A.单质①是最活泼的非金属单质 B.单质②能使品红溶液褪色
C.单质③保存时加少量水进行水封 D.单质的氧化性是④>③>②>①
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期期中联考化学试卷(解析版) 题型:填空题
(共8分)
某无色溶液,其中可能存在Na+、Ba2+、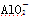 、S2-、
、S2-、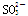 、
、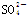 。取该溶液进行有关实验,实验结果如图所示。
。取该溶液进行有关实验,实验结果如图所示。
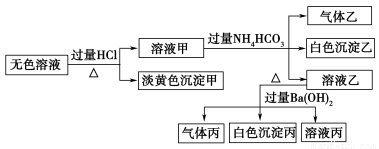
请回答下列问题:
(1)沉淀甲的化学式为________ ,白色沉淀乙的化学式为________
(2)由溶液甲生成沉淀乙的离子方程式为__________________ 。
(3)沉淀丙中一定含有_________(填化学式,下同),可能含有_______________。
(4)综合上述信息,该溶液中肯定存在的离子有_____________ 。
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期期中联考化学试卷(解析版) 题型:选择题
电离度是描述弱电解质电离程度的物理量,电离度=(已电离的电解质的物质的量/原来总的物质的量)×100%。现取20 mL pH=3 的 CH3COOH溶液,加入0.2 mol·L-1的氨水,测得溶液导电性变化如图,则加入氨水前CH3COOH的电离度为
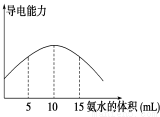
A.0.5% B.1.5% C.0.1% D.1%
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三上学期期中联考化学试卷(解析版) 题型:选择题
常温下,在下列给定条件的各溶液中,一定能大量共存的离子组是
A.使酚酞变红色的溶液:Na+、Ba2+、I-、Cl-
B.使甲基橙变红色的溶液:Fe2+、K+、NO3-、SO42-
C.含有0.1 mol·L-1 Fe3+的溶液:Na+、K+、SCN-、NO
D.由水电离产生的c(H+)=10-12mol·L-1的溶液:NH4+、SO42-、HCO3-、Cl-
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三10月月考化学试卷(解析版) 题型:填空题
(14分)砷(As)广泛分布于自然界,其原子结构示意图是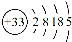 。
。
(1)砷位于元素周期表中 族,其气态氢化物的稳定性比NH3 (填“强”或“弱”)。
(2)砷的常见氧化物有As2O3和As2O5,其中As2O5热稳定性差。根据下图写出As2O5分解为As2O3的热化学方程式: 。
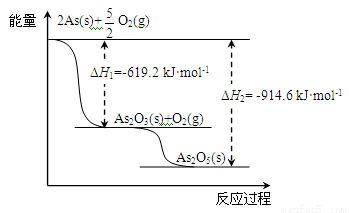
(3)砷酸盐可发生如下反应:AsO43-+2I﹣+2H+  AsO33-+I2+H2O。下图装置中,C1、C2是石墨电极。
AsO33-+I2+H2O。下图装置中,C1、C2是石墨电极。
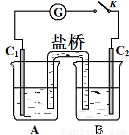
① A中盛有棕色的KI和I2的混合溶液,B中盛有无色的Na3AsO4和Na3AsO3
的混合溶液,当连接开关K,并向B中滴加浓盐酸时发现灵敏电流计G的指针
向右偏转。此时C2上发生的电极反应是 。
② 一段时间后,当电流计指针回到中间“0”位时,再向B中滴加过量浓NaOH
溶液,可观察到电流计指针 (填“不动”、“向左偏”或“向右偏”)。
(4)利用(3)中反应可测定含As2O3和As2O5的试样中的各组分含量(所含杂质对测定无影响),过程如下:
① 将试样溶于NaOH溶液,得到含AsO43-和AsO33-的混合溶液。As2O5与NaOH溶液反应的离子方程式是 。
② 上述混合液用0.02500 mol·L-1的I2溶液滴定,消耗I2溶液20.00 mL。滴定完毕后,使溶液呈酸性,加入过量的KI,析出的I2又用0.1000 mol·L-1的Na2S2O3溶液滴定,消耗Na2S2O3溶液30.00 mL。(已知2Na2S2O3+I2=Na2S4O6+2NaI)试样中As2O5的质量是 g。
查看答案和解析>>
科目:高中化学 来源:2015届浙江省高三10月月考化学试卷(解析版) 题型:选择题
如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是
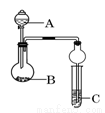
A.若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀溶解
B.若A为浓硫酸,B为炭,C中盛有品红溶液,则C中溶液红色褪色
C.若A为浓硝酸,B为金属铜,C中盛有淀粉KI溶液,则C中溶液变蓝
D.若A为浓盐酸,B为MnO2,C中盛石蕊试液,则C中溶液先变红后褪色
查看答案和解析>>
科目:高中化学 来源:2015届河南省10月联考化学试卷(解析版) 题型:选择题
下列说法中,正确的有( )
(1)明矾可用于水的消毒净化;碳酸钡不可用于钡餐透视
(2)氮氧化物和碳氢化合物是构成光化学烟雾的重要物质
(3)氨常用作制冷剂,是因为其沸点极低,很容易液化
(4)硅的提纯与应用,促进了半导体元件与集成芯片的发展,可以说“硅是信息技术革命的催化剂”
(5)在硫酸亚铁铵的制备实验中,为了得到硫酸亚铁铵晶体,应小火加热蒸发皿,直到有大量晶体析出时停止加热
(6)通电时,溶液中溶质粒子分别向两极移动,胶体中胶粒向某一极移动
(7)铝粉和氧化镁粉末混合,高温能发生铝热反应
(8)高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遭遇强碱会“断路”
(9)可用稀盐酸、碳酸钠溶液、硅酸钠溶液设计实验来验证氯、碳、硅三种元素的非金属性
(10)同主族元素的简单阴离子还原性越强,水解程度越大
(11)Al2O3在工业上用于制作耐高温材料,也用于电解法治炼铝
(12)在硫酸铜结晶水含量测定实验中,至少要用天平称量三次质量
(13)将水蒸汽通过灼热的铁粉,粉末变红,说明铁在高温条件下可与水发生化学反应
(14)先取少量试液于试管中,再加入氢氧化钠溶液,将润湿的红色石蕊试纸放在试管口,红色石蕊试纸不变蓝,证明溶液中不含铵根离子。
(15)已知次磷酸(H3PO2)是一元中强酸,则NaH2PO2是正盐
A.8句 B.6句 C.5句 D.7句
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com