
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇:
( CO2 + 3H2 = CH3OH + H2O ),并开发出直接以甲醇为燃料的燃料电池。
已知 H2(g)、 CO(g) 和 CH3OH(l) 的燃烧热△H分别为-285.8 kJ·mol-1、-283.0 kJ·mol-1和-726.5kJ·mol-1。请回答下列问题:
(1)用太阳能分解10mol水消耗的能量是_____________kJ
(2)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,考察温度对反应的影响,实验结果如图所示(注:T1、T2均大于300℃);下列说法正确的是________(填序号)
 ①温度为T1时,从反应开始到平衡,生成甲醇的
①温度为T1时,从反应开始到平衡,生成甲醇的
平均速率为v(CH3OH)= 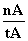 mol·L-1·min-1
mol·L-1·min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时 增大
增大
(3)在T1温度时,将1molCO2和3molH2充入一密闭恒容容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为 ( 用 a 表示 )
(4)已知甲醇燃烧的化学方程式为2CH3OH +3O2 =2CO2 +4H2O ,在直接以甲醇为燃料电池中,电解质溶液为酸性,负极的反应式为 ,正极的反应式
为
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
下列叙述错误的是( )
A.废弃的干电池不能随意丢弃,但可以土埋处理
B.马口铁(镀锡铁)镀层破损后即失去保护作用
C.不能将铁制自来水管与铜制水龙头连接使用
D.电化学腐蚀过程中存在电极反应,产生微电流
查看答案和解析>>
科目:高中化学 来源: 题型:
原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关,下列说法中不正确的是( )
A.由Al、Cu、稀H2SO4组成原电池,放电时SO42-向Al电极移动
B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-===AlO2-+2H2O
C.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-===Cu2+
D.由Al、Cu、浓硝酸组成原电池作电源,用石墨电极来电解硝酸银溶液,当析出1 mol Ag时,消耗铜电极32 g
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:(NH4)2CO3(s)=NH4HCO3(s)+NH3(g) △H = + 74.9 kJ·mol-1,下列说法中正确的是 ( )
A.该反应中熵变、焓变皆大于0
B.该反应是吸热反应,因此一定不能自发进行
C.碳酸盐分解反应中熵增加,因此任何条件下所有碳酸盐分解一定自发进行
D.能自发进行的反应一定是放热反应,不能自发进行的反应一定是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关,下列说法中不正确的是( )
A.由Al、Cu、稀H2SO4组成原电池,放电时SO42-向Al电极移动
B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-===AlO2-+2H2O
C.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-===Cu2+
D.由Al、Cu、浓硝酸组成原电池作电源,用石墨电极来电解硝酸银溶液,当析出1 mol Ag时,消耗铜电极32 g
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式中正确的是 ( )
A.氯气与水反应: Cl2 + H2O= 2H+ +Cl- +ClO-
B.氯气通入氢氧化钠溶液中:2Cl2 + 2OH- =3Cl- +ClO- +H2O
C.氯化亚铁溶液中滴加过量新制氯水:2Fe2+ +Cl2 = 2Fe3+ + 2Cl-
D.少量碳酸钙固体加入足量稀盐酸中:CO32- +2H+ = CO2↑ + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于元素性质的有关叙述中不正确的是
A. S Cl F H的原子半径依次减小
B. Na Mg Al Si的失电子能力依次增强
C. C N O F的气态氢化物的稳定性依次增强
D. Si P S Cl的最高价氧化物的水化物的酸性依次增强
查看答案和解析>>
科目:高中化学 来源: 题型:
元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构。下列推测不正确的是  ( )
( )
 A.同周期元素中X的金属性最强 B.同周期元素中Y的最高价含氧酸的酸性最强
A.同周期元素中X的金属性最强 B.同周期元素中Y的最高价含氧酸的酸性最强
 C.原子半径X>Y,离子半径X+>Z2- D.同族元素中Z的氢化物稳定性最高
C.原子半径X>Y,离子半径X+>Z2- D.同族元素中Z的氢化物稳定性最高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com