
��������ƣ�Na2S2O3)��Ʒ���������������������մ�������ѧ�ϳ����� �ζ�ʵ�顣ij��ѧ��ȤС����ʵ�����Ʊ���������ƾ��岢̽���仯ѧ���ʡ�
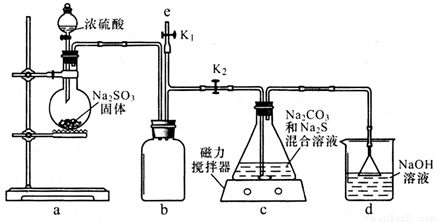
I.�Ʊ� Na2S2O3
(1)��ͼ���ر�K1��K2�� ��Ӧ��ʼ��װ��c�еIJ���� �� Na2S2O3���һ����ɫ��ζ �����壬����������______��
(2)װ��c�з�Ӧ������ �ȹرշ�Һ©����������e���� ��ʢNaOH��Һ��ע�������ٹر�K2��K1 ,��Ŀ����_______________����c����Һ��ȴ����������ͨ��������������ȴ�ᾧ����Ȳ������Na2S2O3 CH2O���塣
(3)ʵ�������װ��d�е����ʿ�����__________________��
̽��Na2S2O3�IJ��ֻ�ѧ����
������������Na2S2O3���Կ�����һ��Sԭ��ȡ���� Na2SO4��һ��Oԭ���γɵġ��ݴ� �Ʋ⣬����˵����ȷ����____________��
A.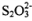 ��
��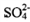 ������������ṹ B.
������������ṹ B.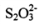 ��������ļ�������������
��������ļ�������������
C.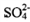 �еļ��Ǿ�Ϊ
�еļ��Ǿ�Ϊ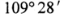 D.
D.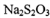 ������ԭ�Ӷ�����8���ӽṹ
������ԭ�Ӷ�����8���ӽṹ
��������衿��Na2S2O3��Na2SO4�ṹ���ƣ���ѧ����ҲӦ�����ƣ��������ʱNa2S2O3 ��ҺpH=7���ڴ�SԪ�صĻ��ϼ��Ʋ�Na2S2O3���н�ǿ�Ļ�ԭ�ԡ�
����֤���衿��������Na2S2O3��Һ����������ʵ�飨�����):
ʵ����� | ʵ������ | ������ͣ������ӷ���ʽ��ʾ�� | |
�� | ___________________ | ��ҺpH=8 | ___________ |
�� | ��������ˮ�е�������Na2S2O3��Һ | ��ˮ��ɫ | _____________ |
��ʵ����ۡ�__________________
 ��Ȥ����¹�֪��ϵ�д�
��Ȥ����¹�֪��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�꽭��ʡ�ϲ��С��鶼��ѧ��������ѧ��ʮ���С�ɣ����ѧ�߶�3��������ѧ�Ծ��������棩 ���ͣ�ѡ����
25��ʱ��ij��Һ����ˮ�������c��OH����=1��10��13mol/L������Һ��һ�����ܴ����������������
A. NH4+��Fe3+��SO42����Cl�� B. HCO3����Na+��HSO3����K+
C. Na+��SO42����NO3����Cl�� D. CO32����PO43����K+��Na+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ��ɽ��ʡ��ׯ�б�У����һ��ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪̼�����ֳ�����ͬλ�أ�12C��13C��14C����Ҳ������ͬλ�أ�16O��17O��18O����������ԭ�ӹ��ɵĶ�����̼���������
A. 18�� B. 6�� C. 9�� D. 12��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�����ɹų���������ظ���һģ�����ۺϻ�ѧ�Ծ��������棩 ���ͣ������
���ǵ����Ϻ����ḻ��һ��Ԫ�أ����̵����ڹ�ũҵ������������Ҫ���ã��Ǽ���������ѧ��һֱ�о��Ŀ��⡣�±��о��˲�ͬ�¶��´����̵���ҵ�̵��IJ���Kֵ��
��Ӧ | �����̵� N2(g)+O2(g) | ��ҵ�̵� N2(g)+3H2(g) | |||
�¶�/�� | 27 | 2000 | 25 | 400 | 450 |
K | 3.84��10-31 | 0.1 | 5��10-8 | 2��104 | 7��103 |
��1���ٷ������ݿ�֪�������̵���Ӧ����___________������ȡ����ȡ�����Ӧ��
����һ���¶��£���һ�����N2��O2ͨ�뵽���Ϊ1L���ܱ������У����������̵�����Ӧ�ﵽƽ��ı�������������ʹƽ��������Ӧ�����ƶ���ƽ�ⳣ���������_______��
a������ѹǿ b������Ӧ���Ũ�� c��ʹ�ô��� d�������¶�
�� �ӷ��ӽṹ�ǶȽ��͡������̵����͡���ҵ�̵�����Ӧ�Ļ�ܶ��ܸߵ�ԭ��________��
��2�������������ݿ�֪�������̵����ķ�Ӧ������еij̶�С�����ʺϴ��ģ��������������������úϳɰ��ķ������й�ҵ�̵���
�ٴ�ƽ���ƶ��Ƕȿ��ǣ���ҵ�̵�Ӧ��ѡ������������ʵ�ʹ�ҵ����ȴѡ��500�����ҵĸ��£�������ԭ��_______________________��
�ڽ�0.1molN2��0.1molH2ͨ��һ�ݻ��ɱ�������н��й�ҵ�̵���Ӧ������ͼ��ʾN2��ƽ��ת�����ڲ�ͬѹǿ(P1��P2)�����¶ȱ仯��������ȷ����____________���A�� ��B��)���Ƚ�P1��P2�Ĵ�С��ϵ________����300�桢ѹǿP2ʱ�ﵽƽ�⣬�����ݻ�ǡΪ100L�����״̬�·�Ӧ��ƽ�ⳣ��K=______________ (����������2λ��Ч����)��

�ۺϳɰ���Ӧ�ﵽƽ���t1ʱ�̰���Ũ��������ͼC�仯�ɲ�ȡ�Ĵ�ʩ��____________��

��3��������꣬���п�ѧ������ڳ��¡���ѹ�������������ºϳɰ�������˼·����Ӧԭ��Ϊ��2N2(g)+6H2O(l)?4NH3(g)+3O2(g)�����䷴Ӧ�ȡ�H=____________��
����֪��N2(g)+3H2(g)?2NH3(g) ��H1=-92.4kJ•mol-1��2H2(g)+O2(g)?2H2O(l) ��H2=-571.6kJ•mol-1 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�����ɹų���������ظ���һģ�����ۺϻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
��NAΪ�����ӵ�������ֵ������˵����ȷ����
A. ��״���£�22.4 L������O2��N2��������ĿΪNA
B. 0.1 mol�ǻ�������������ĿΪNA
C. 28 g��ϩ����ϩ�������������ԭ����Ϊ6NA
D. 5.6 g����������ȫ��Ӧʱת�Ƶĵ�����ĿΪ0.3NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�����ʡ����2��ģ�������ۺϻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
���칬һ�š�ʹ�������ع��硣�����صĸ�������Ϊ����Ͻ��á���ʾ�����Ե�ԭ������Ͻ�)���ܷ�ӦΪ ������˵����ȷ����
������˵����ȷ����
A. ��س��ʱ��ԭ�ӱ�����
B. ��طŵ�ʱ����ΪNiOOH
C. ��س��ʱ�����Դ���������ĵ缫��ӦΪ��
D. ��طŵ�ʱ��������ӦΪ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ʡ�߶�2��������ѧ�Ծ��������棩 ���ͣ������
2016��9���ҹ��ɹ����ô������ػ�����䡰�칬���š��ռ�ʵ���ҡ�����ƽ�����װ�л�ԭ����(N2H4)��Һ̬����ǿ��������������(H2O2)����ͼ��һ��������ȫ��Ӧ���ɵ�����1 mol��̬ˮ�����е������仯ͼ��
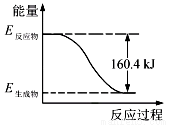
��1���÷�Ӧ����________������ȡ����ȡ�����Ӧ��
��2��д���û���ƽ�������ط�Ӧ���Ȼ�ѧ����ʽ��__________________��
��3�����û���ƽ�����H2O2��12 mol���ۼ��������ѣ���Ӧ�ͷų�������______kJ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ʡ�߶�2��������ѧ�Ծ��������棩 ���ͣ�ѡ����
2016��ȫ���������������������Ҫ���Ը��ƻ�������Ϊ���ģ�ʵ�����ϸ�Ļ��������ƶȣ���ô�����ˮ��������Ⱦ��������ս�ۣ�ȷ��2020����̬��������������ơ��������йػ���������˵���У���ȷ����
A. Ŧ����п�������С�����к������٣��ú�������ⶪ��
B. ��ʯȼ����ȫȼ�ղ�����ɴ�����Ⱦ
C. ��ú��������ȼ�տɼ��ٴ�����Ⱦ
D. ����̼����������ܼ��ţ�Ӧ��ֹʹ�û�ʯȼ�ϣ�������ˮ�ŷ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ��ɽ��ʡ��һ��ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�⻯�(LiH)�������ӻ����LiH��ˮ��Ӧ���Էų�������������������ȷ����
A��LiH��ˮ��Һ������ B��LiH�е������ӿ��Ա���ԭ��������
C��LiH��һ��ǿ������ D��LiH�������ӱ�����ӵİ뾶��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com