
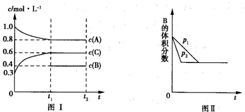
 向一体积不变的密闭容器中加入2mol A、0.6mol C和一定量的B三种气体.一定条件下发生反应,各物质的物质的量浓度随时间变化的曲线如图Ⅰ所示.若保持其他条件不变,压强分别为p1和p2时,B的体积分数与时间的关系曲线如图Ⅱ所示.下列结论正确的是( )
向一体积不变的密闭容器中加入2mol A、0.6mol C和一定量的B三种气体.一定条件下发生反应,各物质的物质的量浓度随时间变化的曲线如图Ⅰ所示.若保持其他条件不变,压强分别为p1和p2时,B的体积分数与时间的关系曲线如图Ⅱ所示.下列结论正确的是( )| 2mol |
| 1mol/L |
| 1 |
| 2 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 6 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:
 碘钨灯具有使用寿命长、节能环保等优点.一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生如下的可逆反应:
碘钨灯具有使用寿命长、节能环保等优点.一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生如下的可逆反应:查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)碘钨灯具有使用寿命长、节能环保等优点。一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生如下的可逆反应:
W(s)+ I2(g) WI2(g)ΔH<0
为模拟上述反应,在450℃时向一体积为2L的恒容密闭容器中加入0.1mol碘单质和足量的钨,2min后反应达到平衡,测得碘蒸气浓度为0.005 mol·L-1。请回答下列问题:
(1)前两分钟内碘蒸气的反应速率为 ▲ 。
(2)能够说明上述反应已经达到平衡状态的有 ▲ 。
A.I2与WI2的浓度相等
B.容器内气体压强不再变化
C.W的质量不再变化
D.单位时间内,金属钨消耗的物质的量与碘化钨生成的物质的量相等
E.容器内混合气体的密度保持不变
(3)下图为该反应在450℃时的时间—速率图,则t2时刻改变的外界条件可能是 ▲ ,若t4时刻将容器压缩至一半(各物质状态不变),保持该条件至t6,请在图中画出t4到t6时间段内大致曲线图,并在相应曲线上标上υ3(正)、υ3(逆)
t0 t1 t2 t3 t4 t5 t6 t
(4)假设灯丝温度为660℃,灯泡壁温度为350℃。请根据化学反应原理分析在灯泡内充入碘能够延长钨丝寿命的原因 ▲ 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省日照市高三第一次模拟考试理综化学试卷(解析版) 题型:填空题
人工固氮是指将氮元素由游离态转化为化合态的过程。
I.最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H+)实验氮的固定一电解法合成氨,大大提高了氮气和氢气的转化率。总反应式为:N2(g)+3H2(g)  2NH3(g),则在电解法合成氨的过程中,应将H2不断地通入_________极(填“阴”或“阳”) ;向另一电极通入N2,该电极的反应式为__________________________。
2NH3(g),则在电解法合成氨的过程中,应将H2不断地通入_________极(填“阴”或“阳”) ;向另一电极通入N2,该电极的反应式为__________________________。
II.据报道,在一定条件下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,主要产物为NH3,相应的反应方程式为:2N2(g)+6H2O(g) 4NH3(g)+3O2(g) △H=Q。
4NH3(g)+3O2(g) △H=Q。
(1)上述反应的平衡常数表达式为_______________。
(2)取五份等体积N2和H2O的混合气体(物质的量之比均为1:3),分别加入体积相同的恒容密闭容器中,在温度不相同的情况下发生反应,反应相同时间后,测得氮气的体积分数 与反应温度T的关系曲线如图所示,则上述反应的Q________0(填“>”、“<”或“=”)。
与反应温度T的关系曲线如图所示,则上述反应的Q________0(填“>”、“<”或“=”)。

(3)若上述反应在有催化剂的情况下发生,则下图所示的a、b、c、d四条曲线中,能表示反应体系能量变化的是_______(选填字母代号),图中△H的绝对值为1530kJ·mol-1。

III.目前工业合成氨的原理是:N2(g)+3H2(g)  2NH3(g) △H=-93.0kJ/mol。
2NH3(g) △H=-93.0kJ/mol。
回答下列问题:
(1)结合II中的数据,则O2(g)+2H2(g)=2H2O(g)的△H=______________。
(2)在一定温度下,将1molN2和3mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8mol。
①达平衡时,H2的转化率α1=______________。
②在相同条件下,若起始时只将NH3置于该容器中,达到平衡状态时NH3的转化率为α2,当α1+α2=1时,则起始时NH3的物质的量n(NH3)=_____________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com