
| A、KSP(PbS)<Ksp(CuS) |
| B、原生铜的硫化物具有还原性,而铜蓝没有还原性 |
| C、CuSO4与ZnS反应的离子方程式是Cu2++s2-=CuS↓ |
| D、在自然界也发生着溶解度小的矿物转化为溶解度更小的矿物的现象 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、Na+、H+、Cl-、NO3- |
| B、K+、Ba+、OH-、I- |
| C、Cu2+、Al3+、Br-、HCO3- |
| D、Fe3+、Mg2+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、滴入甲基橙显红色的溶液中:K+、Fe2+、Cl-、NO-3 |
| B、常温时,水电离出的c(H+)=1×10-12mol?L-1的溶液中:K+、AlO-2、CH3COO-、SiO2-3 |
| C、c(OH-)/c(H+)=1012的溶液中:SO2-3、NH+4、NO-3、K+ |
| D、c(SCN-)=0.1 mol?L-1的溶液中:Fe3+、NH+4、NO-3、Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Q1+Q2+Q3 |
| B、1.5Q1-0.5Q2+0.5Q3 |
| C、0.5Q1-1.5Q2+0.5Q3 |
| D、0.5 (Q1+Q2+Q3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeI2溶液中通入过量Cl2:2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- |
| B、已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO2:2ClO-+CO2+H2O═2HClO+CO32- |
| C、向含有硫酸钙的水垢中加入碳酸钠溶液:CaSO4+CO32-═CaCO3+SO42- |
| D、等体积、等浓度的Ba(OH)2稀溶液与NH4HCO3稀溶液混合:Ba2++2OH-+NH4++HCO3-═BaCO3↓+NH3↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
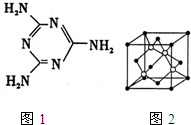 (1)三聚氰胺分子的结构简式如图1所示,则其中氮原子轨道杂化类型是
(1)三聚氰胺分子的结构简式如图1所示,则其中氮原子轨道杂化类型是
查看答案和解析>>
科目:高中化学 来源: 题型:
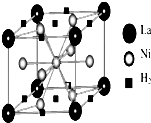 (1)目前,利用金属或合金储氢的研究已取得很大进展,如图是一种镍基合金储氢后的晶胞结构图.
(1)目前,利用金属或合金储氢的研究已取得很大进展,如图是一种镍基合金储氢后的晶胞结构图.| 139 |
| 57 |
| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
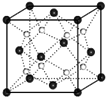 A、B、C、D、E是原子序数依次增大的五种元素.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B是同周期元素中未成对电子最多的;C的基态原子2p能级有1个单电子;D原子中有两个未成对电子且D的核电核数是A与B的核电核数之和的2倍;F有“生物金属”之称,F4+和氩原子的核外电子排布相同;E与F同周期,价电子数为2.请回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
A、B、C、D、E是原子序数依次增大的五种元素.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B是同周期元素中未成对电子最多的;C的基态原子2p能级有1个单电子;D原子中有两个未成对电子且D的核电核数是A与B的核电核数之和的2倍;F有“生物金属”之称,F4+和氩原子的核外电子排布相同;E与F同周期,价电子数为2.请回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验次数 | 样品质量/g | 沉淀质量/g |
| 1 | 2.23 | 1.0 |
| 2 | 4.46 | ? |
| 3 | 6.69 | 2.5 |
| 4 | 8.92 | 2.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com