
【题目】下列变化中需加入氧化剂才能实现的是
A.KMnO4→O2B.Cl-→Cl2C.Fe3+→Fe2+D.H2SO4→CuSO4
 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
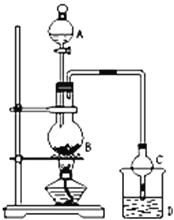
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl26C2H5OH
②有关有机物的沸点和密度:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
密度(g/cm3) | 0.714 | 0.789 | 1.049 | 0.903 |
请回答:
(1)仪器A的名称:______;实验前检查装置气密性良好的方法是_______________________;写出烧瓶B中有关反应的化学方程式:______________________________;
(2)球形干燥管C的作用是_______________,若反应前向D中加入几滴酚酞,溶液呈红色,反应结束后,D中的现象是_________________________________。
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,除去______;再加入(此空从下列选项中选择,四种物质均有吸水性)____________;然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯。
A.浓硫酸B.碱石灰C.无水硫酸钠D.生石灰.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于含碳原子数相同的烯烃与烷烃(如丙烯与丙烷)的说法中,正确的是( )
A.互为同分异构体
B.属于同系物
C.都能在空气中燃烧
D.都能使溴水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以CuSO4溶液和不同酸根离子形成的钠盐溶液作为实验对象,探究盐的性质和盐溶液间反应的多样性。
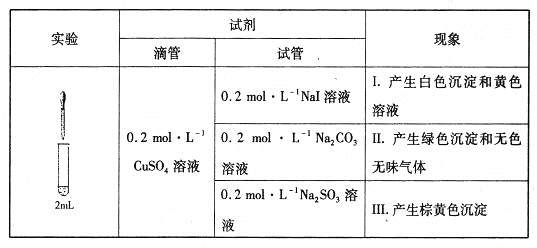
(1)经检验,现象I的白色沉淀为CuI,则反应的离子方程式为_____________________,氧化产物与还原产物的物质的量之比为____________。
(2)经检验,现象Ⅱ中产生的气体是二氧化碳,绿色沉淀是碱式碳酸铜[xCuCO3·yCu(OH)2·zH2O]。现采用氢气还原法测定碱式碳酸铜组成,请回答如下问题:
①写出xCuCO3·yCu(OH)2·zH2O与氢气反应的化学方程式__________________________________________________;
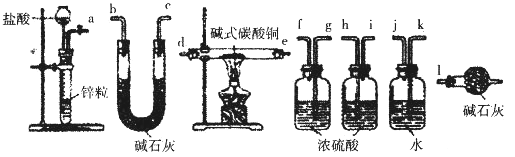
②实验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是(填仪器接口字母编号):a→_______→g f→____→_____→_____→l
(3)经检验,现象Ⅲ的棕黄色沉淀中不含SO42-,含有Cu+、Cu2+和SO32-。
已知:Cu+![]() Cu+Cu2+
Cu+Cu2+
①用稀硫酸证实沉淀中含有Cu+的实验现象是______________________________。
②通过下列实验证实,沉淀中含有Cu2+和SO32-
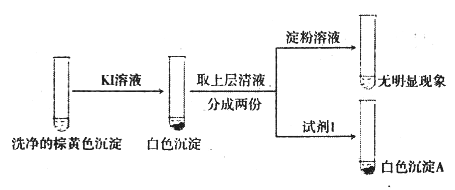
a.白色沉淀A是BaSO4,试剂1是_____________________。
b.证实沉淀中含有Cu+和SO32-的理由是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种物质均含有同一种元素X,它们之间有如下转化关系:

(1)若A为单质,仅B、C属于盐类,且A、B、C中元素X的化合价依次升高,C、D、E中元素X的化合价相同。则D的颜色为__________;E的名称为____________。
(2)若A为单质,B、C均属于盐类,且B、C的水溶液中含X元素的离子所带电荷数之比为3:1,D是一种白色沉淀。则元素X在周期表中的位置是____________;A→C的反应中氧化剂的化学式为___________;C→D反应的离子方程式为__________________________________。
(3)若A~E均为化合物。A是淡黄色固体,C、D、E均属于盐类,D→E→C是我国化学家发明的经典工业制备C的方法。则A的电子式为___________;D→E的化学方程式为:____________________________________。
(4)若A为单质,C、D的相对分子质量相差16,B、E发生反应只生成一种产物,且属于盐类。则B→C的化学方程式为____________________________,E→C_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数,下列说法正确的是( )
A. 常温下,5.6g铁与足量的盐酸反应,失去的电子数为0.3NA
B. 48g O3和O2混合气体所含原子总数为3NA
C. 在100mL18mol/L的浓硫酸中加入过量铜片并加热,生成SO2的分子数为0.9NA.
D. 标准状况下3.36LSO3中含SO3分子数目是0.15NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种功能高分子材料,它具有原料易得、无毒性、与血液和人体组织相容性好,不引起炎症、致癌和过敏等反应,它的最大优点是其单体在通常条件下数秒内就能聚合形成高聚物。因此这种功能高分子材料的单体A是一种迅速缝合伤口的材料,通常就是将单体A涂在手术后的伤口上进行伤口缝合。单体A是由三种化合物合成的,其结构简式如图所示:
![]() 。
。
(1)合成单体A的三种化合物是HCN、__________ 和_____________。
(2)写出A发生固化反应的化学方程式:______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中常含有一定量的Cr2O72-,易被人体吸收积累而导致肝癌。处理工业含铬废水的方法通常是将Cr2O72-转化为Cr3+,再将Cr3+转化为Cr(OH)3沉淀。
(1)利用硫酸工业废气中的SO2 可以处理酸性含铬废水,用离子方程式表示反应原理___________。
(2)已知Ksp[Cr(OH)3]=1×10-30。室温下,除去被SO2还原所得溶液中的Cr3+[使c(Cr3+)≤1×10-6mol·L-1],需调节溶液的pH至少为__________________。
(3)Cr(OH)3和Al(OH)3类似,也是两性氢氧化物,写出Cr(OH)3的酸式电离方程式__________。
(4)Cr3+在强碱中可被双氧水氧化为CrO42-,发生反应的离子方程式为_________________。控制其他条件不变,反应温度对Cr3+转化率的影响如下图所示。请分析温度超过70℃时,Cr3+转化率下降的原因是__________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com