
| A. | 该反应中氨气是还原剂 | B. | 该反应利用了Cl2的强氧化性 | ||
| C. | 该反应HCl是氧化产物 | D. | 生成1molN2有6mol电子转移 |
分析 如果管道漏气,则发生反应3Cl2+2NH3=N2+6HCl,反应中Cl元素的化合价降低,N元素的化合价升高,根据化合价的变化可知生成1molN2有6mol电子转移.
解答 解:A、如果管道漏气,发生反应3Cl2+2NH3=N2+6HCl,反应中氨气的N元素的化合价升高,则氨气为还原剂,故A正确;
B、在3Cl2+2NH3=N2+6HCl反应中,Cl元素的化合价由0价降低为-1价,氯气表现出氧化性,故B正确;
C、Cl元素的化合价由0价降低为-1价,被还原,则HCl为还原产物,故C错误;
D、在3Cl2+2NH3=N2+6HCl反应中,N元素的化合价由-3价升高到0价,则生成1molN2有6mol电子转移,故D正确.
故选C.
点评 本题考查氯气的化学性质和氧化还原反应有关知识,题目难度不大,注意氯气化学性质以及氧化还原反应有关反应的概念的理解.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
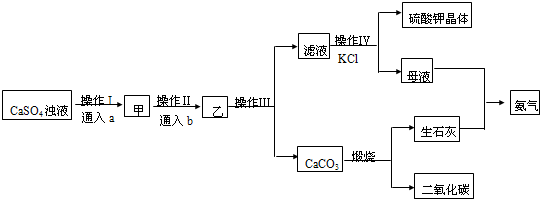
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 Fe(NO3)3溶液中:Mg2+、H+、SO42-、Cl- | |
| B. | 0.1 mol•L-1 KClO溶液中:Na+、H+、Cl-、NO3- | |
| C. | 0.1 mol•L-1氨水中:Ba2+、Ag+、NH4+、NO3- | |
| D. | c(OH-)=10-13 mol•L-1的溶液中:MnO4-、Na+、Br-、CH3CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示装置有洗气、储气等用途.在医院给病人输氧气时,也利用了类似的装置,并在装置中盛放大约半瓶蒸馏水.以下说法不正确的是( )
如图所示装置有洗气、储气等用途.在医院给病人输氧气时,也利用了类似的装置,并在装置中盛放大约半瓶蒸馏水.以下说法不正确的是( )| A. | 导管B连接供给氧气的钢瓶 | |
| B. | 导管B连接病人吸氧气的塑胶管 | |
| C. | 该装置可用来储存氧气,装置中充满蒸馏水,氧气从导管B通入 | |
| D. | 该装置可用来观察从而调节输出氧气的速度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何酸与碱发生中和反应生成1molH2O的过程中,能量变化均相同 | |
| B. | 同温同压下,H2(g)+Cl(g)=2HCl(g)在光照和点燃条件下的△H相同 | |
| C. | 已知:①H2(g)+O2(g)=2H2O(g)△H1=-akJ•mol-1,②2H2(g)+O2(g)=2H2O(I)△H2=-bkJ•mol-1,则a>b | |
| D. | 已知:①C(s,石墨)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1,②C(s,金刚石)+O2(g)=CO2(g)△H2=-393.0kJ•mol-1,则金刚石比石墨稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl气体溶于水时破坏了非极性共价键 | |
| B. | 4.6gNO2溶于水转移0.3mol电子 | |
| C. | 碱金属元素的原子半径越大熔点越低 | |
| D. | 离子化合物和共价化合物在熔融状态下都可以导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示,A、B、C、D、E 分别是铁、硝酸铜溶液、二氧化碳、稀硫酸溶液、氢氧化钠溶液中的一种,A是硝酸铜溶液(“-”相连两物质能发生反应).请回答:
如图所示,A、B、C、D、E 分别是铁、硝酸铜溶液、二氧化碳、稀硫酸溶液、氢氧化钠溶液中的一种,A是硝酸铜溶液(“-”相连两物质能发生反应).请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com