


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
| A、氢氟酸的电离过程是吸热的 |
| B、当V=20时,溶液中:c(F-)<c(Na+)=0.1mol?L-1 |
| C、当V<20时,溶液中离子浓度关系可能为:c(Na+)=c(F-) |
| D、当V>20时,溶液中离子浓度关系一定为:c(Na+)>c(F-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、NO3-、OH-、Cl- |
| B、SO42-、Mg2+、Cl-、Na+ |
| C、SO42-、Na+、Mg2+、CH3COO- |
| D、Cl-、SCN-、K+、Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 利用Cu+2FeCl3=CuCl2+2FeCl2反应,设计一个原电池.
利用Cu+2FeCl3=CuCl2+2FeCl2反应,设计一个原电池.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| B、c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
| C、c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| D、c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 实验内容 | 实验目的 |
| A | 室温下,使用pH计测定浓度均为0.1mol/L NaClO、CH3COONa的pH | 比较HClO和CH3COOH的酸性强弱 |
| B | 向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,再加入新制银氨溶液,水浴加热 | 检验蔗糖水解产物具有还原性 |
| C | 向新生成的AgCl悬浊液中滴入KI溶液 | 研究沉淀的转化 |
| D | 室温下,向两支装有同体积同浓度过氧化氢溶液的试管中,分别加入3滴同浓度的氯化铜、氯化铁溶液 | 研究催化剂对反应速率的影响 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
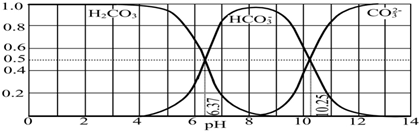
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com