
某实验小组在进行双氧水分解的实验时发现:大家取不同浓度的双氧水及不同质量的二氧化锰进行的实验,产生气体的速率都不相同,那么过氧化氢分解的最佳催化条件是什么呢?他们决定进行探究。
(1)用下列简图,画出实验装置(含试剂)示意图。

(2)小组经过实验,取得如下数据:
|
Z | 0.1 g | 0.3 g | 0.5 g |
| 1.5% | 223 s | 67 s | 56 s |
| 3.0% | 308 s | 109 s | 98 s |
| 4.5% | 395 s | 149 s | 116 s |
(说明:表中X是二氧化锰的质量;Y是指反应停止时的时间;Z是双氧水的质量分数)分析表中数据回答下列问题:
①相同浓度的双氧水的分解速率随着二氧化锰用量的增加而________。
②从实验效果和“绿色化学”的角度考虑,双氧水的浓度相同时,加入________g的二氧化锰为较佳选择,理由是
________________________________________________________________________
________________________________________________________________________。
③该小组的小茂同学分析上述数据后得出“当用相同质量的二氧化锰时,双氧水的浓度越小,所需要的时间就越小,亦即其反应速率越快”的结论,你认为是否正确?________,理由是________________________________________________________________________
________________________________________________________________________。
解析:定量实验的数据分析是解题关键,而数据分析时要固定一个量,然后分析该固定量下其他量的变化。如该题中固定双氧水的浓度为1.5%时,变化的量是二氧化锰的质量,从给出的三组数据可以发现相同双氧水浓度下过氧化氢的分解速率与二氧化锰质量之间的关系。
答案:(1)
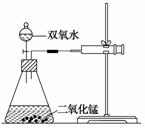
(2)①加快
②0.3 因为用0.1 g的催化剂反应速率明显小于用0.3 g和0.5 g的;用0.5 g的催化剂和用0.3 g的催化剂反应速率相差不多,但用0.3 g的催化剂却节约药品,所以使用0.3 g的二氧化锰为较佳选择
③不正确 因为从表中数据可知,相同体积3%的双氧水中的溶质含量是1.5%的两倍,但反应的时间却比其反应时间的2倍小得多,由反应速率计算公式(v=Δc/Δt)可得出,此实验条件下双氧水的浓度越大,分解速率越快


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
已知反应2I-+S2O82-====I2+2SO42-,加入淀粉溶液可观察到溶液变蓝色。反应速率可
以用淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。20℃时得到如下实验数据:
| 实验编号 | C(I-)/ mol•L | C(S2O82-)/ mol•L | t/s |
| 1 | 0.040 | 0.040 | 88.0 |
| 2 | 0.080 | 0.040 | 44.0 |
| 3 | 0.080 | 0.080 | 22.0 |
| 4 | 0.160 | 0.020 | 44.0 |
| 5 | 0.120 | 0.040 | 29.3 |
分析上述数据,下列说法正确的是( )。
A.该实验的目的是研究 I- 与S2O82- 的浓度对反应速率的影响
B.I-的浓度越大,反应速率越快
C.S2O82- 的浓度越大,反应速率越快
D.5个实验中,编号3对应浓度的实验,反应速率最快
查看答案和解析>>
科目:高中化学 来源: 题型:
关于催化剂的叙述,正确的是( )
A.催化剂在化学反应前后性质不变
B.催化剂在反应前后质量不变,故催化剂不参加化学反应
C.使用催化剂可以改变反应达到平衡的时间
D.催化剂可以提高反应物的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
下列条件一定能使化学反应速率加快的是( )
①增加反应物 ②升高温度
③缩小反应容器的体积 ④加入生成物
⑤加入MnO2
A.全部 B.①②⑤
C.② D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、黏合剂及印刷、纺织等工业。乙酸乙酯的实验室和工业制法常采用如下反应:CH3COOH+C2H5OH CH3COOC2H5+H2O。请根据要求回答下列问题:
CH3COOC2H5+H2O。请根据要求回答下列问题:
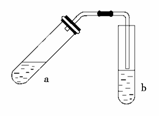
(1)试管a中需加入浓硫酸、冰醋酸和乙醇各2 mL,正确的加入顺序及操作是
________________________________________________________________________。
(2)为防止a中的液体在实验时发生暴沸,在加热前应采取的措施是
________________________________________________________________________。
(3)实验中加热试管a的目的是:①__________________;
②________________________________________________________________________。
(4)此反应以浓硫酸为催化剂,可能会造成____________、____________________等问题。
(5)目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作此反应的催化剂,且能重复使用。实验数据如下表所示(乙酸和乙醇以等物质的量混合)。
| 同一反应时间 | 同一反应温度 | ||||
| 反应温度/℃ | 转化率/% | 选择性/% | 反应时间/h | 转化率/% | 选择性/% |
| 40 | 77.8 | 100 | 2 | 80.2 | 100 |
| 60 | 92.3 | 100 | 3 | 87.8 | 100 |
| 80 | 92.6 | 100 | 4 | 92.3 | 100 |
| 120 | 94.5 | 98.7 | 6 | 93.0 | 100 |
| 选择性100%表示反应生成的产物是乙酸乙酯和水 |
①根据表中数据,下列________(填字母)为该反应的最佳条件。
A.120 ℃,4 h B.80 ℃,2 h
C.60 ℃,4 h D.40 ℃,3 h
②当反应温度达到120 ℃时,反应选择性降低的原因可能为
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在一固定容积的密闭容器中发生反应:2NO2(g) 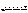 N2O4(g),达平衡时,再向容器内通入一定量的NO2,重新达到平衡后,与第一次平衡相比,NO2的体积分数( )
N2O4(g),达平衡时,再向容器内通入一定量的NO2,重新达到平衡后,与第一次平衡相比,NO2的体积分数( )
A.不变 B.增大
C.减小 D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【化学—选修有机化学基础】(15分)
现有分子式为CnH8O2X2的物质M,可发生如下所示转化:
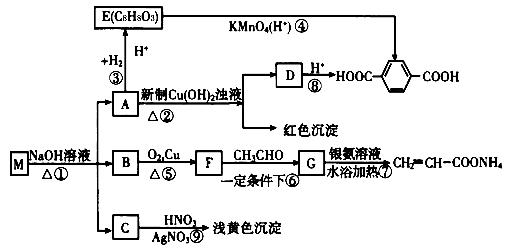
已知:①物质B在质谱分析中,在质谱图显示存在多种质荷比不相同的粒子,其中质荷比最大的为32,物质B在核磁共振氢谱分析中,有两个吸收峰,吸收峰面积之比为3∶1。
②两个—OH同时连在一个C原子上,结构不稳定,会自动失水,如:
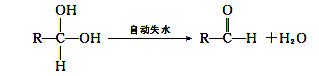
请回答下列问题:
(1)n值为 ,X为 (填元素符号)。
(2)③的反应类型: 。
(3)写出E、G的结构简式;
E: ; G: 。
(4)写出下列反应的化学方程式:
A→D: ;
B→F: 。
(5)写出一种符合下列条件的E的同分异构体的结构简式
①属于酯
②属于酚
③不能发生银镜反应
④苯环上的一溴代物只有两种 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列排序正确的是( )
①热稳定性:H2O>HF>H2S ②原子半径:Na>Mg>O
③酸性:H3PO4>H2SO4>HClO4 ④结合H+的能力:OH—>CH3COO—>Cl—
A.①③ B.②④ C.①④ D.②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com