
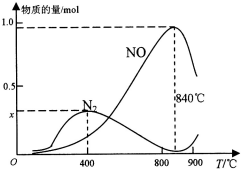
 氨催化氧化是硝酸工业的基础,按要求回答下列问题:
氨催化氧化是硝酸工业的基础,按要求回答下列问题:| 化学键 | N-H |  | O-H | O=O |
| E/(kJ•mol-1) | x | y | m | n |
分析 (1)①4NH3(g)+5O2(g)?4NO(g)+6H2O(g),反应的焓变△H=反应物键能总和-生成物的键能总和;
②依据化学平衡的三行式列式计算,气体压强之比等于气体物质的量之比,用平衡分压代替平衡浓度计算平衡常数,分压=总压×物质的量分数,达到平衡后,保持温度不变,将反应容器的体积增大一倍,压强减小平衡向气体体积增大的方向进行;
(2)①在上述1L的密闭容器中加入l mol NH3和1.5mol O2的反应过程中还发生4NH3+3O2?N2+6H2O反应,400℃时,混合气体中NH3、N2、NO的物质的量比为5:6:3,结合氮元素守恒计算x;
②氨气和氧气的反应为放热反应,温度高于840℃后,各物质的物质的量发生变化,NO减小,氮气增加,结合化学平衡影响因素分析判断.
解答 解:(1)①4NH3(g)+5O2(g)?4NO(g)+6H2O(g),反应的焓变△H=反应物键能总和-生成物的键能总和=12x+5n-4y-12m,
故答案为:12x+5n-4y-12m;
②400℃时,在1L的密闭容器中加入l mol NH3和1.5mol O2,测得平衡时容器的压强为p,且比反应前压强增大了4%,设达到平衡状态消耗氨气物质的量为x,
4NH3(g)+5O2(g)?4NO(g)+6H2O(g),
起始量(mol) 1 1.5 0 0
变化量(mol) x 1.25x x 1.5x
平衡量(mol) 1-x 1.5-1.25x x 1.5x
(1-x+1.5-1.25x+x+1.5x)=(1+1.5)(1+4%)
x=0.4mol,
则该温度下NH3的转化率=$\frac{0.4mol}{1mol}$×100%=40%,
平衡总物质的量=3.5mol,
用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,该反应的平衡常数Kp=$\frac{(p×\frac{1.5×0.4}{3.5})^{6}(p×\frac{0.4}{3.5})^{4}}{(p×\frac{0.6}{3.5})^{4}(p×\frac{1.5-1.25×0.4}{3.5})^{5}}$=3.545×10-3p,
反应前后气体物质的量增大,达到平衡后,保持温度不变,将反应容器的体积增大一倍,压强减小平衡向正反应方向进行,
故答案为:40%;3.545×10-3p;正反应,对气体分子数增大的反应,减小压强平衡向正反应方程移动;
(2)①在上述1L的密闭容器中加入l mol NH3和1.5mol O2的反应过程中还发生4NH3+3O2?N2+6H2O反应,已知400℃时,混合气体中NH3、N2、NO的物质的量比为5:6:3,结合氮元素守恒计算,5y+6y×2+3y=1
y=0.05
氮气物质的量=6y=0.05mol×6=0.3mol,
x=0.3
故答案为:0.3;
②上述计算分析可知,NH3生成NO和N2的反应分别属于放热反应,温度高于840℃后,各物质的物质的量发生如图所示变化,NO减小,N2物质的量增大,可能是氨气高温分解生成氮气和氢气,使氨气氧化生成NO平衡向左移动;NO高温分解生成氮气和氧气;氨气和NO反应生成氮气和水,
故答案为:放热反应,放热反应;可能是氨气高温分解生成氮气和氢气,使氨气氧化生成NO平衡向左移动;NO高温分解生成氮气和氧气;氨气和NO反应生成氮气和水.
点评 本题考查了化学平衡影响因素、化学平衡常数的计算、图象比较、数据处理等知识点,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Na2SO4=Na2++SO42- | B. | MgCl2=Mg2++Cl- | ||
| C. | HNO3=H++3NO- | D. | Ba(OH)2=Ba2++2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠用于治疗胃酸过多 | |
| B. | 阿司匹林常用于解热镇痛 | |
| C. | 青霉素是一种常用的抗生素,使用前没有必要进行皮肤敏感实验 | |
| D. | 非处方药都无毒副作用,可长期大量服用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器换号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH2(g) | H2O(g) | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 207 | 0.20 | 0.090 | 0.090 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入稀有气体使压强增大,平衡将正向移动 | |
| B. | X的正反应速率是Y 的逆反应速率的$\frac{m}{n}$倍 | |
| C. | 降低温度,混合气体的平均相对分子质量变小 | |
| D. | 增加X的物质的量,平衡常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com