
在0℃1.01×105Pa时,下列混和气体的平均相对分子质量有可能为52.2的是:
A、H2S和SO2 B、NO和O2 C、SO3和CO2 D、HI和Cl2
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| ||
| SO2 | O2 | SO3 | |
| 反应开始时的浓度 /mol?L-1 |
3.0 | 1.5 | 0 |
| 10min后的浓度 /mol?L-1 |
2.0 2.0 |
1.0 1.0 |
1.0 1.0 |
| 平均反应速率 /mol?L-1min-1 |
0.1 0.1 |
0.05 0.05 |
0.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 17 |
| 2 |
| 17 |
| 2 |
| c(CO2)2 |
| c(CO)2×c(O2) |
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:021
A.在0℃1.01×105Pa的条件下,某气体的体积为2.24×10-2m3,该气体的物质的量为1 mol
B.1mol某气体的体积为22.4L,该气体所处的状况必定为标准状况
C.在0℃的温度下,1mol某气体的体积为22.4L,该气体的压强为101 kPa
D.固态的二氧化碳又叫做干冰。含CO21mol的干冰在标准状况下的体积必定小于22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
在水的电离平衡中,![]() 和
和![]() 的关系如下图所示:
的关系如下图所示:
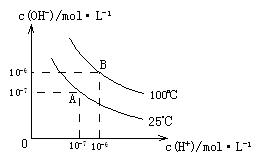
(1)A点水的离子积为1×10-14,B点水的离子积为 。造成水的离子积变化的原因是 。
(2)25℃时,![]() 在水溶液中的电离方程式为:
在水溶液中的电离方程式为:
![]() ,
,![]()
![]()
![]() 。
。
① 0.1 mol/L![]() 溶液的pH 1(填“>”、“<”或“=”)。
溶液的pH 1(填“>”、“<”或“=”)。
②在0.1 mol/L![]() 溶液中,各离子浓度由大到小的顺序是:
溶液中,各离子浓度由大到小的顺序是:
。
(3)100℃时,0.01 mol/L![]() 溶液的pH = 。
溶液的pH = 。
(4)100℃时,将pH =8的![]() 溶液与pH =5的稀盐酸混合,并保持100℃恒温,欲使混合溶液的pH =7,则
溶液与pH =5的稀盐酸混合,并保持100℃恒温,欲使混合溶液的pH =7,则![]() 溶液与盐酸的体积比为 。
溶液与盐酸的体积比为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com