
【题目】化合物H是一种香料,存在于金橘中,可用如下路线合成:
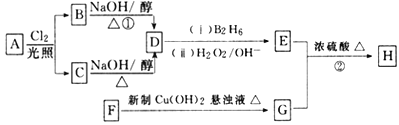
已知:R-CH=CH2![]() RCH2CH2OH (B2H6为乙硼烷)。
RCH2CH2OH (B2H6为乙硼烷)。
回答下列问题:
(1)11.2L(标准状况)的烃A在氧气中充分燃烧可以产生88gCO2和45gH2O。A的分子式是___________;
(2)B和C均为一氯代烃,它们的名称(系统命名)分别为___________________;
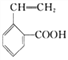
(3)在催化剂存在下1molF与2molH2反应,生成3-苯基-1-丙醇。F的结构简式是__________________;
(4)反应①的反应类型是____________________;
(5)反应②的化学方程式为______________________________________________;
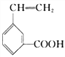
(6)写出所有与G具有相同官能团的G的芳香类同分异构体的结构简式_________________________________。(写任何一种)
【答案】 C4H10 2-甲基-1-氯丙烷,2-甲基-2-氯丙烷 ![]() 消去反应
消去反应 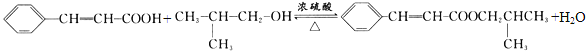
![]()
![]()
【解析】试题分析:11.2L(标准状况)的烃A在氧气中充分燃烧可以产生88gCO2和45gH2O,根据烃A燃烧的通式![]() 计算A的分子式,通过计算,A的分子式是
计算A的分子式,通过计算,A的分子式是![]() ;根据题意A能生成2种一氯代物,A的结构简式是
;根据题意A能生成2种一氯代物,A的结构简式是![]() ;B、C分别是
;B、C分别是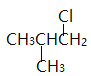 、
、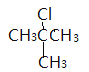 ;B、C在氢氧化钠的醇溶液中发生消去反应生成D,D是
;B、C在氢氧化钠的醇溶液中发生消去反应生成D,D是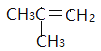 ;根据R-CH=CH2
;根据R-CH=CH2![]() RCH2CH2OH,
RCH2CH2OH,![]() ,E是
,E是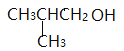 ;F能与新制氢氧化铜反应生成G,则F是醛、G是酸,1molF与2molH2反应,生成3-苯基-1-丙醇,F是
;F能与新制氢氧化铜反应生成G,则F是醛、G是酸,1molF与2molH2反应,生成3-苯基-1-丙醇,F是![]() 、G是
、G是![]() ;G、E发生酯化反应生成H,H是
;G、E发生酯化反应生成H,H是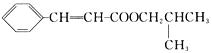 。
。
解析:根据以上分析,(1)设烃A的分子式是![]() ,
,
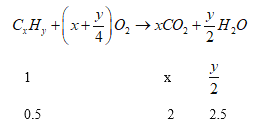
则x=4,y=10;所以A的分子式是![]() ;
;
(2)A能生成2种一氯代物,A的结构简式是![]() ;B、C分别是
;B、C分别是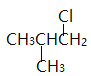 、
、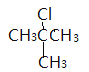 ;它们的名称(系统命名)分别为2-甲基-1-氯丙烷、2-甲基-2-氯丙烷;(3)F能与新制氢氧化铜反应生成G,则F是醛、G是酸,1molF与2molH2反应,生成3-苯基-1-丙醇,F是
;它们的名称(系统命名)分别为2-甲基-1-氯丙烷、2-甲基-2-氯丙烷;(3)F能与新制氢氧化铜反应生成G,则F是醛、G是酸,1molF与2molH2反应,生成3-苯基-1-丙醇,F是![]() ;
;
(4)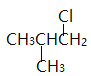 、
、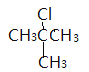 在氢氧化钠的醇溶液中发生消去反应生成
在氢氧化钠的醇溶液中发生消去反应生成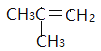 ,反应①的反应类型是消去反应;(5)
,反应①的反应类型是消去反应;(5)![]() 与
与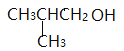 发生酯化反应的方程式是
发生酯化反应的方程式是 ;
;
(6)与G具有相同官能团的G的芳香类同分异构体的结构简式有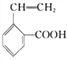
![]()
![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
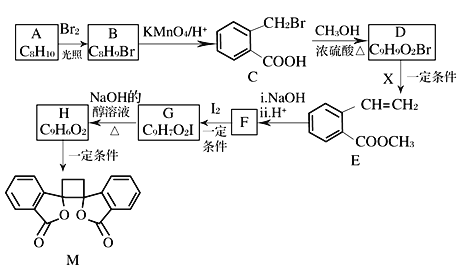
【题目】我国北方的山岗荒坡间有一种草本植物,别名奈何草,其中含有抗菌作用的某有机物M的合成路线如下图所示:
已知:ⅰ.RCH2Br![]() R—HC=CH—R'
R—HC=CH—R'
ⅱ.R—HC=CH—R' ![]()
![]()
ⅲ.R—HC=CH—R' ![]()
![]() (以上R、R'、R″代表氢、烷基或芳基等)
(以上R、R'、R″代表氢、烷基或芳基等)
(1)A的化学名称为_____,B的核磁共振氢谱显示为_____组峰。
(2)由C生成D的反应类型为_____。
(3)1 mol M与足量NaOH溶液反应,消耗_____mol NaOH。
(4)X的结构式为_____,F的结构简式为_____________。
(5)由G生成H的化学方程式为_______________________________。
(6)符合下列条件的E的同分异构体共_____种(不考虑立体异构)。
①芳香族化合物 ②与E具有相同官能团 ③能发生银镜反应 ④酸性条件下水解产物遇氯化铁溶液显紫色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.实验室用下图装置制取并研究SO2的性质。
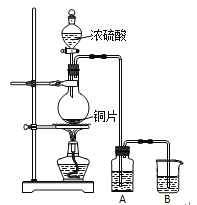
完成下列填空:
(1)圆底烧瓶中反应的化学方程式为_____________________________________。
(2)若A中盛放品红溶液,可以验证的SO2性质是______________。若要验证SO2的还原性,A中应盛放_________溶液。B中应盛放_________溶液。
II.为测定反应后的溶液中残留的硫酸浓度,实验小组进行如下探究。
(3)甲组:取1 mL反应液加水稀释至100 mL,再取10 mL稀释液与足量锌粒用下图装置进行测定。在读取反应前后量气管中液面读数时应先调节水准管与量气管中液面等高,这样操作的目的是________。
实验测得反应生成的氢气体积为22.4 mL(已换算到标准状况),计算原反应液中残留的硫酸浓度为______mol/L。

(4)乙组:欲通过加入足量的BaCl2溶液,测定生成的BaSO4沉淀质量来达到实验目的。该设计思路不可行,理由是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定Na2CO3和NaHCO3混合物样品的组成,称取不同质量样品溶于水后分别逐滴加入相同浓度盐酸30 mL,充分反应,产生CO2的体积(已折算成标准状况下的体积)与加入样品的质量关系如图所示(不考虑CO2在水中的溶解、反应)。请计算:

(1)样品中n(Na2CO3) : n(NaHCO3)=____________。
(2)盐酸的物质的量浓度c(HCl)=________mol·L1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将浓盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。现有一氧化还原反应的体系,共有KCl、Cl2、浓H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质。
请完成下列填空:
(1)写出一个包含上述体系中七种物质的氧化还原反应方程式(无需配平):_________________________;上述反应中,还原产物是_____________,每转移1 mol电子,生成Cl2 _____ L(标准状况)。
(2)上述反应体系中,有些短周期元素的简单离子核外电子排布相同,它们的简单离子半径由大到小的顺序为______________(用离子符号表达)。
(3)氯原子的最外层电子排布式为_____________________,氯原子核外共有____种不同运动状态的电子。
(4)在上述反应后的溶液中加入NaBiO3(不溶于冷水),溶液又变为紫红色,BiO3-反应后变为无色的Bi3+。比较该反应中的氧化剂和氧化产物的氧化性强弱_______>________。
(5)请用原子结构理论解释上述含7种物质的氧化还原反应体系中,属于同一主族两种元素非金属性的强弱,____>______;______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2002年诺贝尔化学奖获得者的贡献之一是发明了对有机物分子进行结构分析的质谱法。其方法是让极少量的(10-9g)化合物通过质谱仪的离子化室使样品分子大量离子化,少量分子碎裂成更小的离子。如C2H6离子化后可得到C2H6+、C2H5+、C2H4+……,然后测定其质荷比。某有机物样品的质荷比如下图所示(假设离子均带一个单位正电荷,信号强度与该离子的多少有关),则该有机物可能是( )


A. 甲醇 B. 丙烷 C. 甲烷 D. 乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从某含Br—废水中提取Br2的过程包括:过滤、氧化、萃取(需选择合适萃取剂)及蒸馏等步骤。已知:
物质 | Br2 | CCl4 | 正十二烷 |
密度/g·cm-3 | 3.119 | 1.595 | 0.753 |
沸点/℃ | 58.76 | 76.8 | 215~217 |
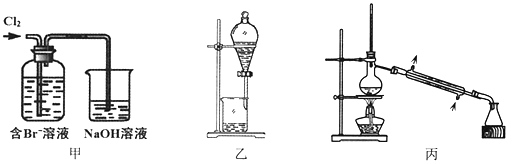
下列说法不正确的是
A. 甲装置中Br—发生的反应为:2Br-+ Cl2 = Br2 + 2Cl-
B. 甲装置中NaOH溶液每吸收0.1mol Cl2,转移0.1mol e—
C. 用乙装置进行萃取,溶解Br2的有机层在下层
D. 用丙装置进行蒸馏,先收集到的是Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒及其化合物在工农业生产中有重要用途,硒也是人体必需的微量元素。
(1)硒(34Se)在周期表中位于硫下方,画出其原子结构示意图_____________。
(2)氧族元素单质均能与H2反应生成H2X,用原子结构解释原因_______________。
(3)298K、1.01×l0-5Pa,O2、S、Se、Te分别与H2化合的反应热数据如图所示。写出Se与H2化合的热化学反应方程式__________________。
(4)可以从电解精炼铜的阳极泥中提取硒,通过化学工艺得到亚硒酸钠等含硒物质。常温下,Se(Ⅳ)溶液中各组分的物质的量分数随pH变化曲线如图。
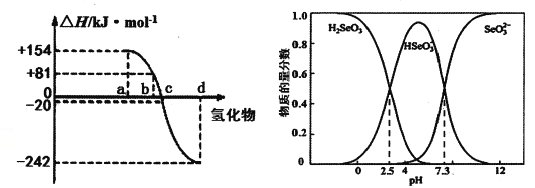
①向亚硒酸溶液滴入NaOH溶液至pH =5,该过程中主要反应的离子方程式________。
②在pH<0的酸性环境下,向Se(Ⅳ)体系中通入SO2制得单质Se的化学方程式是_______。
③下列说法正确的是____(填字母序号)。
a.NaHSeO3溶液显酸性
b.pH=8时,溶液中存在c(HAsO3-)+2c(SeO32-)+c(OH-)=c(H+)
c.在Na2SeO3溶液中,c(SeO32-》c(HSeO3-)> c(H2SeO3)
④常温下,H2SeO3的第二步电离平衡常数为K2,计算K2=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取镁的工业流程如图所示,下列说法不正确的是
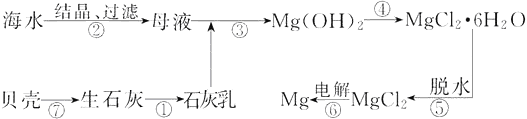
A. 用此法提取镁的优点之一是原料来源丰富
B. 在实验室进行②的操作需用到坩埚、坩埚钳、玻璃棒、酒精灯
C. 步骤⑥电解MgCl2时,副产物Cl2可以循环利用
D. 上述工艺流程中的反应未涉及置换反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com