
| 沉淀物 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | Zn(OH)2 |
| 沉淀开始时pH | 7.5 | 2.2 | 8.8 | 6.5 |
| 沉淀完全时pH | 9.5 | 3.7 | 10.8 | 8.5 |
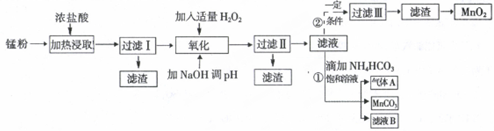
分析 锰粉[含MnO2、MnO(OH)、Zn(NH3)2Cl2、Fe、NH4Cl和炭黑等]在浓盐酸中加热浸取,发生MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O、2MnO(OH)+6HCl=2MnCl2+Cl2↑+4H2O、Fe+2HCl=FeCl2+H2↑等反应,过滤后所得滤渣为碳黑,滤液中含有Mn2+、Fe2+、NH4+、Zn2+等离子,在滤液中加入适量过氧化氢和氢氧化钠,可将Fe2+转化为Fe3+,并生成Fe(OH)3,控制溶液pH在8.5~8.8之间可除去Fe3+、Zn2+,过滤后所得滤渣为Fe(OH)3、Zn(OH)2,滤液Ⅱ中主要为Mn2+,同时滤液中有H2O2溶液在一定条件下能使Mn2+转化成MnO2,经过滤、洗涤、干燥可得MnO2,另外滤液Ⅱ中加碳酸氢铵,过滤得碳酸锰沉淀和滤液B含NH4Cl,以及气体A为CO2,以此解答该题.
解答 解:锰粉[含MnO2、MnO(OH)、Zn(NH3)2Cl2、Fe、NH4Cl和炭黑等]在浓盐酸中加热浸取,发生MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O、2MnO(OH)+6HCl=2MnCl2+Cl2↑+4H2O、Fe+2HCl=FeCl2+H2↑等反应,过滤后所得滤渣为碳黑,滤液中含有Mn2+、Fe2+、NH4+、Zn2+等离子,在滤液中加入适量过氧化氢和氢氧化钠,可将Fe2+转化为Fe3+,并生成Fe(OH)3,控制溶液pH在8.5~8.8之间可除去Fe3+、Zn2+,过滤后所得滤渣为Fe(OH)3、Zn(OH)2,滤液Ⅱ主要为Mn2+,同时滤液中有H2O2溶液在一定条件下能使Mn2+转化成MnO2,经过滤、洗涤、干燥可得MnO2,另外滤液Ⅱ中加碳酸氢铵,过滤得碳酸锰沉淀和滤液B含NH4Cl,以及气体A为CO2,
(1)根据上面的分析可知,过滤Ⅰ得到的滤渣主要成分是 碳黑,
故答案为:碳黑;
(2)流程中氧化后加入NaOH溶液调节PH的范围为8.5<PH<8.8,其作用是除去溶液中的Fe3+、Zn2+,
故答案为:除去溶液中的Fe3+、Zn2+;
(3)根据上面的分析可知,过滤Ⅱ后滤液中阳离子主要是Mn2+,
故答案为:Mn2+;
(4)根据上面的分析可知,生成的气体A是CO2,
故答案为:CO2;
(5)酸性锌锰干电池生成锰粉中给出产物的总反应式为Zn+2MnO2+2NH4Cl=Zn(NH3)2Cl2+2MnOOH,
故答案为:Zn+2MnO2+2NH4Cl=Zn(NH3)2Cl2+2MnOOH;
(6)将4.00g锰粉完全按照上述工艺流程②生产MnO2,并以此测定其中锰元素的含量,首先向制取的MnO2 中加入过量酸化的0.50mol/L H2C2O4,50.00mL,H2C2O4的物质的量为0.50mol/L×0.05L=0.025mol,Mn(OH)2 完全溶解,并产生A气体即二氧化碳气体,该反应的离子方程式:MnO2+H2C2O4+2H+=Mn2++2CO2 ↑+2H2O,然后用0.10mol/L KMnO4溶液滴定过量的H2C2O4溶液(产物与上反应一致),则根据电子得失守恒可知2KMnO4~5H2C2O4,滴定终点时消耗KMnO4溶液30.00mL,则消耗的KMnO4物质的量为0.10mol/L×0.03L=0.003mol,所以与KMnO4反应的H2C2O4的物质的量为0.003mol×$\frac{5}{2}$=0.0075mol,所以与二氧化锰反应的H2C2O4的物质的量为0.025mol-.0075mol=0.0175mol,则二氧化锰的物质的量为0.0175mol,所以锰粉中的锰元素质量分数是$\frac{0.0175mol×55g/mol}{4g}$×100%=24.1%,
故答案为:MnO2+H2C2O4+2H+=Mn2++2CO2 ↑+2H2O;24.1%.
点评 本题考查物质的制备和分离,题目难度中等,注意根据物质的性质把握实验原理,本题易错点为(5),注意根据反应物和生成物结合质量守恒书写离子方程式.


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:多选题
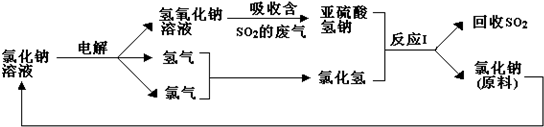
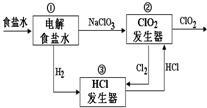 利用食盐水制取ClO2的工业流程如图所示.
利用食盐水制取ClO2的工业流程如图所示.| A. | 该流程中仅NaCl可循环利用 | |
| B. | 装置①中H2是阴极产物 | |
| C. | 装置②中Cl2是还原产物 | |
| D. | 为使H2完全转化为HCl,还应向装置③中再补充Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:
乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 直径为20 nm的纳米碳酸钙属于胶体 | |
| B. | 海水中提取镁的各步反应均为氧化还原反应 | |
| C. | 光导纤维是一种新型硅酸盐材料 | |
| D. | 可溶性铁盐和铝盐可用作净水剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com