
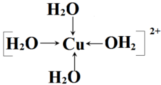
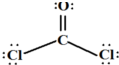
(8分)(1)在配合物Fe(SCN)2+中,提供空轨道接受孤对电子的微粒是________ _______,画出配合物离子 [Cu(NH3)4]2+中的配位键__________ __________ 。
(2)根据价层电子对互斥理论模型(VSEPR模型),H3O+的分子立体结构为:__________ ________________,BCl3的立体结构为:_______ _________________。
(3)按要求写出由第二周期元素为中心原子,通过sp3杂化形成中性分子的化学式:
正四面体分子_______,三角锥形分子________,V形分子_________。(各写一种)
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(7分)(1)在配合物Fe(SCN)2+中提供空轨道接受孤电子对的微粒是 (填符号),画出配合物离子![]() 中的配位键 。
中的配位键 。
(2)根据价层电子对互斥理论,H30+中VSEPR模型名称为 ,BCl3分子的立体结构为 。
(3)按要求写出由第二周期元素为中心原子,通过SP3杂化形成中性分子的化学式(各写一种):正四面体分子 ,三角锥形分子 ,V型分子 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年四川省巴中市四县中高二上期期末联考化学试卷 题型:填空题
(7分)(1)在配合物Fe(SCN)2+中提供空轨道接受孤电子对的微粒是 (填符号),画出配合物离子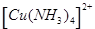 中的配位键 。
中的配位键 。
(2)根据价层电子对互斥理论,H30+中VSEPR模型名称为 ,BCl3分子的立体结构为 。
(3)按要求写出由第二周期元素为中心原子,通过SP3杂化形成中性分子的化学式(各写一种):正四面体分子 ,三角锥形分子 ,V型分子 。
查看答案和解析>>
科目:高中化学 来源:2013届四川省巴中市四县中高二上期期末联考化学试卷 题型:填空题
(7分)(1)在配合物Fe(SCN)2+中提供空轨道接受孤电子对的微粒是 (填符号),画出配合物离子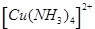 中的配位键 。
中的配位键 。
(2)根据价层电子对互斥理论,H30+中VSEPR模型名称为 ,BCl3分子的立体结构为 。
(3)按要求写出由第二周期元素为中心原子,通过SP3杂化形成中性分子的化学式(各写一种):正四面体分子 ,三角锥形分子 ,V型分子 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com