
| A. | 在标准状况下,11.2LNO与11.2LO2混合后气体分子数为0.75NA | |
| B. | 7.8gNa2O2与足量的CO2反应时转移的电子数为0.2NA | |
| C. | 1L 1 mol/L的醋酸溶液中所含离子总数为2NA | |
| D. | 常温常压下,16gO3所含的原子数为NA |
分析 A、NO和氧气反应后生成的NO2中存在平衡:2NO2?N2O4;
B、求出过氧化钠的物质的量,然后根据过氧化钠和二氧化碳反应时,1mol过氧化钠转移1mol电子来分析;
C、醋酸是弱电解质,不能完全电离;
D、臭氧由氧原子构成.
解答 解:A、NO和氧气反应后生成的NO2中存在平衡:2NO2?N2O4,导致分子个数减少,则最终分子个数小于0.75NA个,故A错误;
B、7.8g过氧化钠的物质的量为0.1mol,而过氧化钠和二氧化碳反应时,1mol过氧化钠转移1mol电子,故0.1mol过氧化钠转移0.1NA个电子,故B错误;
C、醋酸是弱电解质,不能完全电离,故溶液中的离子个数小于2NA个,故C错误;
D、臭氧由氧原子构成,故16g臭氧中含有的氧原子的物质的量为n=$\frac{16g}{16g/mol}$=1mol,个数为NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | 氧化铁是金属氧化物 | 可做染料 |
| B | 氢氧化铝具有弱碱性 | 可用于制胃酸中和剂 |
| C | SiO2是酸性氧化物 | SiO2能与水反应生成硅酸 |
| D | 硬铝是合金 | 其熔点比金属铝的熔点高 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 凡pH<7的雨水就可看作“酸雨” | |
| B. | 燃烧不一定要有氧气的参加,但燃烧一定是氧化还原反应 | |
| C. | 用NaClO溶液代替Cl2作为漂白剂是由于它难分解且在空气中可转化为HClO | |
| D. | 玻璃是氧化物,成分可表示为Na2OCaO•6SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
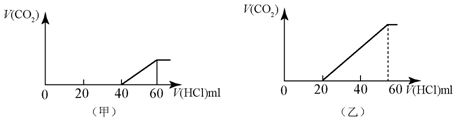
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
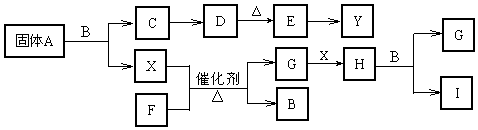
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
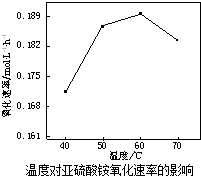 利用氨水吸收烟气中的二氧化硫,其相关反应的主要热化学方程式如下:
利用氨水吸收烟气中的二氧化硫,其相关反应的主要热化学方程式如下: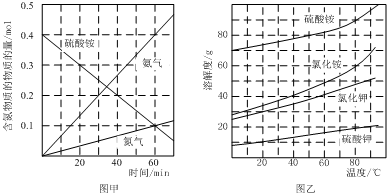
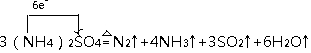 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com