
对金属制品进行抗腐蚀处理,可延长其使用寿命。
(1)以下为铝材表面处理的一种方法: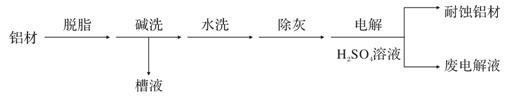
① 碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,原因是____(用离子方程式表示)。为将碱洗槽液中铝以沉淀形式回收,最好向槽液中加入下列试剂中的____.。
a.NH3 b.CO2 c.NaOH d.HNO3
② 以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应为____。取少量废电解液,加入NaHCO3溶液后产生气泡和白色沉淀,产生此现象的原因(用离子方程式表示)_____。
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨作阳极材料的原因是______。
(3)利用下图装置,可以模拟铁的电化学防护。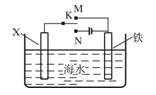
若X为碳棒,为减缓铁的腐蚀,开关K应置于______处。
若X为锌,开关K置于M处,该电化学防护法称为_______。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| ||

| 3b-a |
| 18 |
| 2a-3b |
| 36 |
| 3b-a |
| 18 |
| 2a-3b |
| 36 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 铁、铝是现代金属材料的主角.
铁、铝是现代金属材料的主角.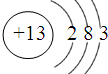

查看答案和解析>>
科目:高中化学 来源: 题型:
 金属铝是应用广泛的金属之一,在工农业生产中有着广泛的应用,对金属制品进行抗腐蚀处理,可延长其使用寿命.
金属铝是应用广泛的金属之一,在工农业生产中有着广泛的应用,对金属制品进行抗腐蚀处理,可延长其使用寿命.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com