
| A. | K+,Mg2+,Cl-,OH- | B. | Na+,Cu2+,CO32-,NO3- | ||
| C. | H+,Na+,CO32-,Cl- | D. | Na+,Mg2+,Cl-,SO42- |
科目:高中化学 来源: 题型:解答题
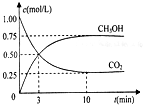 CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标.
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
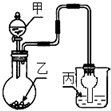 用如图装置进行实验,甲逐滴加入到固体乙中,如表说法正确的是( )
用如图装置进行实验,甲逐滴加入到固体乙中,如表说法正确的是( )| 选项 | 液体甲 | 固体乙 | 溶液丙 | 丙中现象 |
| A | CH3COOH | NaHCO3 | 苯酚钠 | 无明显现象 |
| B | 浓HCl | KMnO4 | 紫色石蕊 | 最终呈红色 |
| C | 浓H2SO4 | Na2SO3 | 品红 | 红色变无色 |
| D | 浓H2SO4 | Cu | 氢硫酸 | 溶液变浑浊 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
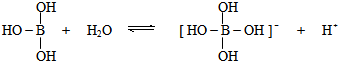 .下列判断正确的是( )
.下列判断正确的是( )| A. | 硼酸是三元酸,抑制水的电离 | |
| B. | 硼酸分子中各原子最外层均达到8电子结构 | |
| C. | 硼酸与NaOH溶液反应的离子方程式:H3BO3+OH-═[B(OH)4]- | |
| D. | 硼酸是两性氢氧化物,也能与强酸溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,其与过量的NaOH溶液反应的化学方程式是
,其与过量的NaOH溶液反应的化学方程式是 +2NaOH→
+2NaOH→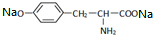 +2H2O.
+2H2O.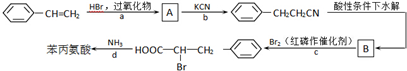
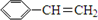 +HBr→
+HBr→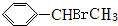 .
. +Br2$\stackrel{红磷}{→}$
+Br2$\stackrel{红磷}{→}$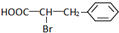 +HBr.
+HBr.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
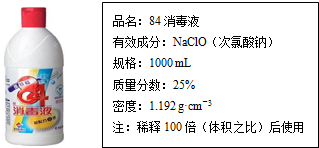
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
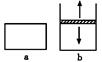
| A. | x的值为2 | |
| B. | B物质可为固体或液体 | |
| C. | 平衡时,a容器的体积小于V L | |
| D. | a、b容器中从起始到平衡所需时间相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com