
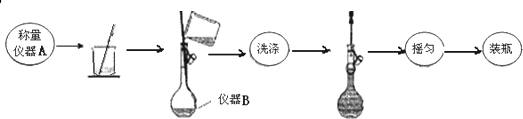
| A. | ①②③④ | B. | ②③④① | C. | ④③②① | D. | ②③①④ |
分析 检验溴乙烷中溴元素使卤代烃中的卤素原子变为卤离子,溴乙烷可以在氢氧化钠水溶液中水解生成卤离子,也可以在氢氧化钠醇溶液中发生消去反应生成卤离子,最后加入硝酸酸化,加入硝酸银,观察是否有黄色沉淀生成,以此来解答.
解答 解:为了检验溴乙烷中含有溴元素,不能直接向溴乙烷中滴加硝酸银溶液来检验,是因为溴乙烷中不含有溴离子;
检验溴乙烷中含有溴元素一定要将之转化为溴离子,可以采用卤代烃的水解方法或在氢氧化钠醇溶液中发生消去反应生成卤离子,即加入氢氧化钠选②,再加热,发生水解反应生成NaBr选③,用HNO3酸化溶液至溶液呈酸性选④,最后加入硝酸银溶液,生成淡黄色沉淀,则证明含溴元素选①,
即操作顺序为②③④①,
故选B.
点评 本题考查离子的检验,为高频考点,把握有机物的结构与性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意有机物性质的应用,题目难度不大.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
. .
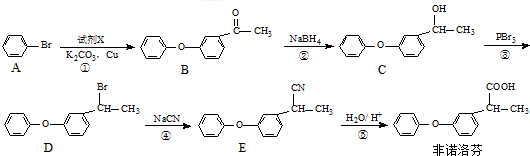
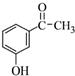
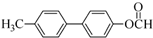
.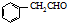 为原料制备
为原料制备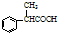 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C=CH2$→_{催化剂}^{H_{2}O}$CH3CH2OH$→_{浓硫酸△}^{CH_{3}COOH}$CH3COOC2H5.
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C=CH2$→_{催化剂}^{H_{2}O}$CH3CH2OH$→_{浓硫酸△}^{CH_{3}COOH}$CH3COOC2H5.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
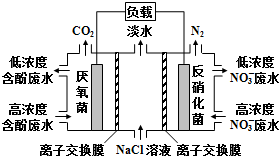
| A. | 右室电极为该电池的正极 | |
| B. | 左室电极反应式可表示为:C6H5OH-28e-+11H2O═6CO2↑+28H+ | |
| C. | 右室电极附近溶液的pH减小 | |
| D. | 工作时中间室的Cl-移向左室,Na+移向右室 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com