
【题目】实验室制氨气常用以下两种方法:
①用固体氢氧化钙与氯化铵晶体反应制取;
②用固体生石灰与浓氨水混合制取。
请回答下列问题:
(1)写出方法①的化学方程式_______________。
(2)方法②能制取氨气的原理是___________________。
(3)检验氨气是否收集满的方法是______________________。
(4)通常用于证明氨气极易溶于水的实验是______________;氨水显碱性的原因是_____________。
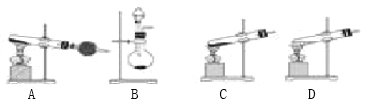
(5)制备氨气的装置如下,方法①应选用_________(填字母,下同),方法②应选用__________。
【答案】Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O 生石灰与水反应使溶剂减少,反应放出大量的热,使混合溶液温度升高,利于氨气逸出 在试管口用湿润的红色石蕊试纸检验,看是否变蓝(或在试管口用蘸有浓盐酸的玻璃棒检验,看是否有白烟生成) 喷泉实验(或其他合理方法) NH3+H2O
CaCl2+2NH3↑+2H2O 生石灰与水反应使溶剂减少,反应放出大量的热,使混合溶液温度升高,利于氨气逸出 在试管口用湿润的红色石蕊试纸检验,看是否变蓝(或在试管口用蘸有浓盐酸的玻璃棒检验,看是否有白烟生成) 喷泉实验(或其他合理方法) NH3+H2O ![]() NH3·H2O
NH3·H2O ![]() NH4++OH- A B
NH4++OH- A B
【解析】
(1)制取NH3的反应为加热NH4Cl和Ca(OH)2反应生成氯化钙、氨气和水;
(2)生石灰与水反应放出大量热,溶液温度升高,氨气的溶解度减小,同时反应消耗掉部分水,溶剂减少溶质析出,氨气从溶液中逸出;
(3)氨气是碱性气体,遇到湿润的红色石蕊试纸变蓝色,与浓盐酸挥发出的氯化氢相遇生成白色固体氯化铵,形成白烟;
(4)由于氨气极易溶解于水,所以当使用喷泉装置进行实验时,会形成喷泉;
(5)用固体氢氧化钙与氯化铵共热制备氨气,是固体和固体加热制备气体的反应,在常温下用固体生石灰与浓氨水反应是固体和液体不加热制备气体。
(1)方法①制取NH3的反应为加热NH4Cl和Ca(OH)2反应生成氯化钙、氨气和水,反应的化学方程式为:Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O,故答案为:Ca(OH)2+2NH4Cl
CaCl2+2NH3↑+2H2O,故答案为:Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(2)采用方法②制取氨气的原理是生石灰与水反应放出大量热,溶液温度升高,氨气的溶解度减小,氨气从溶液中逸出;同时反应消耗掉部分水,溶剂减少溶质析出,氨气从溶液中逸出,故答案为:生石灰与水反应使溶剂减少,反应放出大量的热,使混合溶液温度升高,利于氨气逸出;
(3)氨气是碱性气体,检验氨气是否收集满的方法是用湿润的红色石蕊试纸靠近集气瓶口,如果试纸变蓝,则证明是氨气收集满,或氨气与浓盐酸挥发出的氯化氢相遇生成白色固体氯化铵,形成白烟,故答案为:在试管口用湿润的红色石蕊试纸检验,看是否变蓝(或在试管口用蘸有浓盐酸的玻璃棒检验,看是否有白烟生成);
(4)由于氨气极易溶解于水,所以当使用喷泉装置进行实验时,会形成喷泉,氨气溶解于得到的是氨水,氨水显碱性,原因是:NH3+H2O ![]() NH3·H2O
NH3·H2O ![]() NH4++OH-,故答案为:喷泉实验;NH3+H2O
NH4++OH-,故答案为:喷泉实验;NH3+H2O ![]() NH3·H2O
NH3·H2O ![]() NH4++OH-;
NH4++OH-;
(5)用固体氢氧化钙与氯化铵共热制备氨气,是固体和固体加热制备气体的反应,应选择A装置,在常温下用固体氢氧化钠与浓氨水反应是固体和液体不加热制备气体,应选择B装置,故答案为:A;B。


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
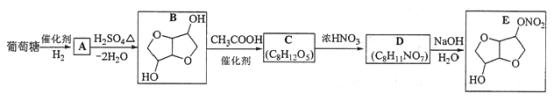
【题目】以葡萄糖为原料制得的山梨醇(A)和异山梨醇(B)都是重要的生物质转化平台化合物。E是一种治疗心绞痛的药物,由葡萄糖为原料合成E的过程如下:
回答下列问题:
(1)葡萄糖的分子式为__________。
(2)A中含有的官能团的名称为__________。
(3)由B到C的反应类型为__________。
(4)C的结构简式为__________。
(5)由D到E的反应方程式为______________。
(6)F是B的同分异构体,7.30 g的F与足量饱和碳酸氢钠反应可释放出2.24 L二氧化碳(标准状况),F的可能结构共有________种(不考虑立体异构),其中核磁共振氢谱为三组峰,峰面积比为3∶1∶1的结构简式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置或操作正确的是
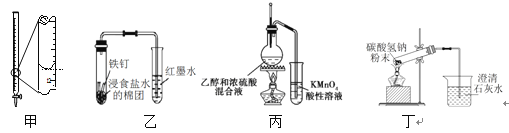
A. 装置甲液面读数为12.20 mL B. 装置乙可探究铁的吸氧腐蚀
C. 装置丙可检验乙烯的生成 D. 装置丁可验证碳酸氢钠受热分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)除去NaNO3固体中混有的少量KNO3,所进行的实验操作依次为________、蒸发、结晶、________。
(2)除去KCl溶液中的SO![]() ,依次加入的溶液为(填溶质的化学式): ________________________。
,依次加入的溶液为(填溶质的化学式): ________________________。
(3)下列物质的分离和提纯方法操作为
①油水混合物________;
②自来水制备蒸馏水________;
③碘水中的I2________;
④KNO3溶液得到KNO3________。
查看答案和解析>>
科目:高中化学 来源: 题型:
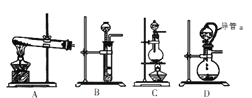
【题目】高纯度镍是许多有机反应的催化剂。某化学课题组拟以电镀废液(含有NiS04、CuSO4和FeSO4)为原料,设计提取高纯镍的简单工艺如下(阴离子省略):

注:Ni(OH)2开始沉淀时的pH=7。
(1)加入新制氯水所发生反应的离子方程式为____
(2)加入NiCO3的目的是________。
(3)由氧化镍制备高纯度镍,有两种方案:
方案1:氧化镍溶于稀硫酸,加入足量锌粉,过滤、洗涤、干燥。
方案2:锌与稀硫酸反应产生氢气,氢气还原氧化镍。
制备等质量的镍粉,从消耗原料量、产品纯度、实验安全角度评价两种方案的优点。
方案1.____
方案2.____
(4)方案2所用的氢气可以选用下列装置中的____来制取(填写字母,下同),收集氢气可选用装置________。
(5)若将D装置和E装置相连制取并收集干燥纯净的X气体,则X气体可以是下列气体中的____。装置D中导管a的作用是____。
a.CO2 b.Cl2 c.NO d.SO2

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是
A. 铝片与盐酸反应Al+2H+===Al3++H2↑
B. 铝粉溶于烧碱溶液2Al+2OH-+2H2O ===2![]() +3H2↑
+3H2↑
C. 铝片放入硫酸铜溶液Al+Cu2+=== Al3++Cu
D. 镁条放入氯化铝溶液Mg+Al3+=== Mg2++Al
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸甲酯M,常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精。M属于芳香族化合物,苯环上只含有一个直支链,能发生加聚反应和水解反应。测得M的摩尔质量为162g·mol-1,只含碳、氢、氧,且原子个数之比为5:5:1。
(1)肉桂酸甲酯的结构简式是______________________。
(2)G为肉桂酸甲酯的一种同分异构体,其分子结构模型如下图所示(图中球与球之间连线表示单键或双键)。G的结构简式为_________________。

(3)用芳香烃A为原料合成G的路线如下:

①化合物E中的官能团有________(填名称)。
②E→F的反应类型是________,
F→G的化学方程式为__________________________________________________。
③写出两种符合下列条件的F的稳定的同分异构体的结构简式_________________。
ⅰ.分子内含苯环,且苯环上只有一个支链;
ⅱ.在催化剂作用下,1mol该物质与足量氢气充分反应,最多消耗5mol H2;
ⅲ.它不能发生水解反应,但可以发生银镜反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成是一个需要经历多步反应的过程,我们常用的塑料包装绳(主要成分为聚氯乙烯 ![]() 就是通过多步反应生产出来的。现在有1,2-二溴乙烷,氢氧化钠醇溶液、二氧化锰、锌粒、稀硫酸,浓盐酸等主要原料,请您设计反应的步骤得到聚氯乙烯,将每一步反应的化学方程式写出:____________________________。
就是通过多步反应生产出来的。现在有1,2-二溴乙烷,氢氧化钠醇溶液、二氧化锰、锌粒、稀硫酸,浓盐酸等主要原料,请您设计反应的步骤得到聚氯乙烯,将每一步反应的化学方程式写出:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨反应:3H2+N2![]() 2NH3在密闭容器中进行。下列有关说法正确的是( )
2NH3在密闭容器中进行。下列有关说法正确的是( )
A. 达到化学平衡时,各物质的浓度不再改变
B. 其他条件不变,升高温度,不能增大反应的速率
C. 使用催化剂可使H2的转化率达到100%
D. 其他条件不变,降低N2的浓度,可以增大反应的速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com