
| A. | 向硫酸铜溶液中加入过量的NaHS溶液:Cu2++2HS-═CuS↓+H2S↑ | |
| B. | 向NH4Al(SO4)2溶液加入含两倍物质的量的Ba(OH)2溶液:Al3++2SO${\;}_{4}^{2-}$+4OH-+2Ba2+═2BaSO4↓+AlO${\;}_{2}^{-}$+2H2O | |
| C. | 向Na2S2O3溶液中通入足量的Cl2:S2O${\;}_{3}^{2-}$+2Cl2+3H2O═2SO${\;}_{3}^{2-}$+4Cl-+6H+ | |
| D. | 用石墨电极电解MgCl2溶液阴极电极反应:2H2O+2e-═H2↑+2OH- |
分析 A.硫酸铜与硫氢化钠溶液反应生成硫化铜、硫化氢气体和硫酸钠;
B.铵根离子结合氢氧根离子能力大于氢氧化铝,氢氧化铝不会溶解;
C.氯气足量,反应生成硫酸根离子;
D.氢氧根离子与镁离子生成氢氧化镁沉淀.
解答 解:A.向硫酸铜溶液中加入过量的NaHS溶液,反应生成硫酸钠、CuS和硫化氢,反应的离子方程式为:Cu2++2HS-═CuS↓+H2S↑,故A正确;
B.向NH4Al(SO4)2溶液加入含两倍物质的量的Ba(OH)2溶液,铵根离子结合氢氧根离子能力大于氢氧化铝,氢氧化铝不会溶解,正确的离子方程式为:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3•H2O,故B错误;
C.向Na2S2O3溶液中通入足量的Cl2,亚硫酸根离子被氧化成硫酸根离子,正确的离子方程式为:S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+,故C错误;
D.用石墨电极电解MgCl2溶液,阴极镁离子与氢氧根离子生成氢氧化镁沉淀,正确的电极反应为:Mg2++2H2O+2e-═H2↑+Mg(OH)2↓,故D错误;
故选A.
点评 本题考查了离子方程式的书写判断,为高考的高频题,属于中等难度的试题,注意明确离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源: 题型:填空题
 (1)将煤转化为水煤气是通过化学方法将煤转化为洁净燃料的方法之一.已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
(1)将煤转化为水煤气是通过化学方法将煤转化为洁净燃料的方法之一.已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可以用丁达尔现象区分溶液和胶体 | |
| B. | 硅是良好的半导体材料,纯净二氧化硅是光导制品的基本原料 | |
| C. | SO2 使高锰酸钾褪色是利用 SO2 的漂白性 | |
| D. | 定容时俯视刻度线,会导致浓度偏高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温、常压下,11.2 L N2含有的分子数是0.5NA | |
| B. | 标准状况下,22.4 L水所含水分子数约是NA | |
| C. | 32 g O2在标准状况下的体积约是22.4 L | |
| D. | 1 mol•L-1FeCl3溶液中所含Cl-的数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
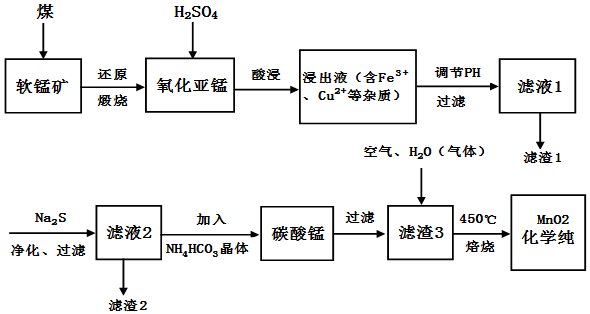
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaO | B. | Ca(OH)2 | C. | SiO2 | D. | Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
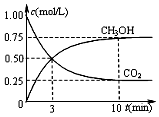 燃煤技术的改进,有助于合理控制温室效应、环境污染,并能进行资源化利用,还可重新获得燃料或重要工业产品.工业上以煤和水为原料通过一系列转化变为清洁能源氢气和工业原料甲醇.
燃煤技术的改进,有助于合理控制温室效应、环境污染,并能进行资源化利用,还可重新获得燃料或重要工业产品.工业上以煤和水为原料通过一系列转化变为清洁能源氢气和工业原料甲醇.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②⑤⑧ | C. | ③⑧⑥ | D. | ⑥⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com