
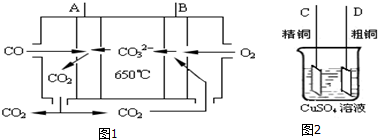
分析 (1)利用盖斯定律可以根据已知的反应的热化学方程式求反应2CO+SO2=S+2CO2的焓变,进而写热化学方程式;
(2)根据CO具有还原性,在负极上发生氧化反应生成CO2,结合电解质书写电极反应式;根据A为负极,B为正极,
粗铜精炼时,粗铜作阳极,与电源的正极相连;根据电子得失守恒以及粗铜中除了铜失去电子还有其他金属失去电子.
解答 解:(1)根据盖斯定律,反应2CO+SO2=S+2CO2的焓变=△H1-△H2-△H3=-270 kJ•mol-1,
故答案为:2CO(g)+SO2(g)=S(s)+2CO2(g);△H3=-270 kJ•mol-1
(2)①CO具有还原性,在负极上发生氧化反应生成CO2,电极反应式为:CO-2e-+CO32-═2CO2,
故答案为:CO-2e-+CO32-=2CO2
②因A为负极,B为正极,粗铜精炼时,粗铜作阳极,与电源的正极相连,
故选:D;
③当消耗1.12L(标况下)CO时,转移0.1mol电子,生成0.05molCu,为0.05mol×64g/mol=3.2g,因粗铜中除了铜失去电子还有其他金属失去电子,根据电子得失守恒可知减少铜的质量小于3.2克,
故答案:3.2.
点评 本题是一道热化学和电化学知识的题目,考查了学生热化学方程式的书写以及电解原理应用的有关知识,综合性强,难度较大.


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 充电时电池反应为FePO4+Li=LiFePO4 | |
| B. | 充电时动力电池上标注“+”的电极应与外接电源的正极相连 | |
| C. | 放电时电池内部Li+向负极移动 | |
| D. | 所用的电解质(溶液)为水(溶液) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧气和臭氧(O3)是氧元素的同素异形体 | |
| B. | 乙酸和甲酸甲酯是同分异构体 | |
| C. | 12C和13C互为同位素 | |
| D. | 软脂酸(C15H31COOH)和油酸(C17H33COOH)是同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{3}{8}$ mol | B. | $\frac{8}{3}$ mol | C. | $\frac{2}{3}$ mol | D. | $\frac{3}{2}$ mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | ||
| B | C | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据能量守恒有Q1+Q2=2Q3 | |
| B. | 该反应中的能量变化为 ︳Q1+Q2-2Q3︳ | |
| C. | 若Q1+Q2>2Q3,则反应为放热反应 | |
| D. | 若1molA2和1molB2的总能量之和小于2molAB的总能量,则反应为放热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com