
【题目】合成氨是基本无机化工,氨是化肥工业和有机化工的主要原料,也是一种常用的制冷剂.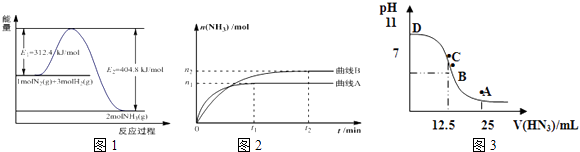
(1)图1是合成氨反应的能量与反应过程相关图(未使用催化剂);图2是合成氨反应在2L容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图.①下列说法正确的是 .
A.使用催化剂会使E1的数值增大
B.△H=﹣92.4kJmol﹣1
C.为了提高转化率,工业生产中反应的温度越低越好
D.在曲线A条件下,反应从开始到平衡,消耗N2的平均速率为 ![]() molL﹣1min﹣1
molL﹣1min﹣1
E.该反应的平衡常数KA<KB
F.图2是不同压强下反应体系中氨的物质的量与反应时间关系图,且PA<PB
②下列能说明该反应达到平衡状态的是
A.容器内N2、H2、NH3的浓度之比为1:3:2
B.v正(N2)=v逆(H2)
C.混合气体的密度保持不变
D.容器内压强保持不变
(2)合成氨技术的创立开辟了人工固氮的重要途径,合成氨反应的平衡常数K值和温度的关系如下:
温度/℃ | 200 | 300 | 400 |
K | 1.0 | 0.86 | 0.5 |
400°C时,测得某时刻氨气、氮气、氢气的物质的量浓度分别为3molL﹣1、2molL﹣1、1molL﹣1时,此时刻该反应的v逆(N2)v正(N2) (填“>”、“<”或“=”).
(3)常温下向25mL0.1mol/LNH3H2O 溶液中,逐滴加入 0.2mol/L的HN3溶液,溶液的pH变化曲线如图3所示.A、B、C、D四个点中,水的电离程度最大的是;A点时溶液中各离子浓度由小到大的顺序为 .
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl﹣NH4Cl为电解质溶液制造新型燃料电池.试写出该电池的正极反应式 .
【答案】
(1)BDE;D
(2)>
(3)C;c(OH﹣)<c(H+)<c(NH4+)<c(N3﹣)
(4)N2+8H++6e﹣═2NH ![]()
【解析】解:(1)①A.使用催化剂改变反应途径,降低反应的活化能E1 , 故A错误;B.由图可知,反应焓变△H=312.4KJ/mol﹣404.8KJ/mol=﹣92.4kJ/mol,故B正确;C.反应是放热反应,温度越低平衡正向进行,提高原料利用率,但温度过低,反应速率减慢,生成效率和经济效益低,故C错误;D.v(NH3)= ![]() =
= ![]() mol/(L.min),速率之比等于化学计量数之比,v(N2)=
mol/(L.min),速率之比等于化学计量数之比,v(N2)= ![]() v(NH3)=
v(NH3)= ![]() mol/(L.min),故D正确, E.平衡常数只受温度影响,先拐先平温度高,升温平衡逆向进行,反应的平衡常数KA<KB , 故E正确; F.由先拐先平压强大,则压强pA>pB , 增大压强平衡正向移动,氨气物质的量增大,图象中压强越大,氨气物质的量越小,不符合实际,故F错误;所以答案是:BDE;②A.平衡时各物质的浓度关系与起始浓度及转化率有关,不一定等于其化学计量数之比,故A错误; B.应是3v正(N2)=v逆(H2)时反应到达平衡,故B错误; C.混合气体总质量不变,容器容积不变,混合气体的密度为定值,故C错误; D.随反应进行混合气体物质的量减小,恒温恒容下压强减小,当容器内压强保持不变时,反应到达平衡,故D正确;所以答案是:D;(2)此时浓度商Qc=
mol/(L.min),故D正确, E.平衡常数只受温度影响,先拐先平温度高,升温平衡逆向进行,反应的平衡常数KA<KB , 故E正确; F.由先拐先平压强大,则压强pA>pB , 增大压强平衡正向移动,氨气物质的量增大,图象中压强越大,氨气物质的量越小,不符合实际,故F错误;所以答案是:BDE;②A.平衡时各物质的浓度关系与起始浓度及转化率有关,不一定等于其化学计量数之比,故A错误; B.应是3v正(N2)=v逆(H2)时反应到达平衡,故B错误; C.混合气体总质量不变,容器容积不变,混合气体的密度为定值,故C错误; D.随反应进行混合气体物质的量减小,恒温恒容下压强减小,当容器内压强保持不变时,反应到达平衡,故D正确;所以答案是:D;(2)此时浓度商Qc= ![]() =4.5>K=0.5,反应向逆反应进行,则v正(N2)<v逆(N2),所以答案是:>;(3)开始为氨水溶液,抑制水的电离,C点加入HN3溶液体积为12.5mL,恰好反应得到NH4N3溶液,溶液显碱性,说明HN3为弱酸,而再加入HN3溶液,又抑制水的电离,故恰好反应的C点的水的电离程度最大; A点加入25mL HN3溶液,此时为等浓度的NH4N3、HN3混合溶液,溶液呈酸性,说明NH4+离子水解程度大于的N3﹣水解程度,反应中离子浓度大小由小到大是的顺序为:c(OH﹣)<c(H+)<c(NH
=4.5>K=0.5,反应向逆反应进行,则v正(N2)<v逆(N2),所以答案是:>;(3)开始为氨水溶液,抑制水的电离,C点加入HN3溶液体积为12.5mL,恰好反应得到NH4N3溶液,溶液显碱性,说明HN3为弱酸,而再加入HN3溶液,又抑制水的电离,故恰好反应的C点的水的电离程度最大; A点加入25mL HN3溶液,此时为等浓度的NH4N3、HN3混合溶液,溶液呈酸性,说明NH4+离子水解程度大于的N3﹣水解程度,反应中离子浓度大小由小到大是的顺序为:c(OH﹣)<c(H+)<c(NH ![]() )<c(N3﹣),所以答案是:C;c(OH﹣)<c(H+)<c(NH
)<c(N3﹣),所以答案是:C;c(OH﹣)<c(H+)<c(NH ![]() )<c(N3﹣);(5)原电池正极发生还原反应,氮气在正极获得电子,与电解质反应中氢离子结合为铵根离子,正极电极反应式为:N2+8H++6e﹣═2NH4+ , 所以答案是:N2+8H++6e﹣═2NH4+ .
)<c(N3﹣);(5)原电池正极发生还原反应,氮气在正极获得电子,与电解质反应中氢离子结合为铵根离子,正极电极反应式为:N2+8H++6e﹣═2NH4+ , 所以答案是:N2+8H++6e﹣═2NH4+ .
【考点精析】解答此题的关键在于理解化学平衡状态本质及特征的相关知识,掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效),以及对化学平衡状态的判断的理解,了解状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、R为前四周期元素,且原子序数依次增大.XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;R2+离子的3d轨道中有9个电子.
(1)Y基态原子的电子排布式是;Z所在周期中第一电离能最大的主族元素是
(2)XY2﹣离子的立体构型是;R2+的水合离子中,提供孤电子对的原子是 .
(3)Z与某元素形成的化合物的晶胞如图所示,晶胞中阴离子与阳离子的个数比是 . 
(4)将R单质的粉末加入XH3的浓溶液中,通入Y2 , 充分反应后溶液呈深蓝色,该反应的离子方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中各微粒的浓度关系正确的是( )
A.pH相等的①NH4Cl溶液、②(NH4)2SO4溶液、③NH4HSO4溶液,溶液中c(NH4+)的大小顺序为①>②>③
B.pH相等的NaF溶液与CH3COOK溶液:[c(Na+)﹣c(F﹣)]>[c(K+)﹣c(CH3COO﹣)]
C.0.2 mol?L﹣1Na2CO3溶液:c(OH﹣)=c(HCO![]() )+c(H+)+c(H2CO3)
)+c(H+)+c(H2CO3)
D.0.2 mol?L﹣1盐酸与0.1 mol?L﹣1NaAlO2溶液等体积混合:c(Cl﹣)>c(Na+)>c(Al3+)>c(H+)>c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe(OH)3胶体的制备实验:向_____________中逐滴加入______________________溶液;继续煮沸至溶液呈______________色,停止加热。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国产铜主要取自黄铜矿(CuFeS2),湿法炼铜工艺的核心是黄铜矿的浸出,目前主要有氧化浸出、配位浸出和生物浸出三种方法。
I.氧化浸出
(1)在硫酸介质中用双氧水将黄铜矿氧化,测得有SO42-生成。
①该反应的离子方程式为________________________________.
②该反应在25—50℃下进行,实际生产中双氧水的消耗量要远远高于理论值,试分析其原因为__________________________________________________
Ⅱ,配位浸出
反应原理为:CuFeS2+NH3·H2O+O2+OH-→ Cu(NH3)42++Fe2O3+SO42-+H2O(未配平)
(2)用化学用语解释氨水溶液的酸碱性______________________________.
(3)生产中为了稳定溶液的pH,可以在浸出液加入___________________(物质名称)Ⅲ.生物浸出
在反应釜中加入黄铜矿、硫酸铁、硫酸和微生物,并鼓入空气,黄铜矿逐渐溶解,反应釜中各物质的转化关系如图所示。
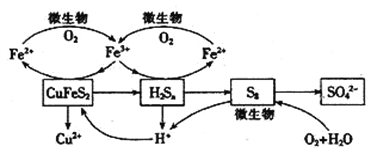
(4)在微生物的作用下,可以循环使用的物质有_________(填化学式),微生物参与的离子反应方程式为_______________________________(任写一个)。
(5)假如黄铜矿中的铁元素最终全部转化为Fe3+,当有2 mol SO42-生成时,理论上消耗O2的物质的量为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对1 mol N2和1 mol CO2进行比较,下列说法不正确的是
A.分子数一定相同 B.原子数一定不相同
C.体积一定相同 D.质量一定不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 氯气溶于水:Cl2+H2O==2H++Cl-+ClO-
B. 过量HI溶液加入到Fe(NO3)3溶液中:2Fe3++2I-=2Fe2++I2
C. 酸性溶液中KBrO3与KBr反应生成Br2:BrO3-+Br-+6H+=Br2+3H2O
D. NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+ Ba2++OH-=BaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,浓硫酸既表现强氧化性,又表现酸性的是
①2NaC1(固)+ H2SO4(浓) ![]() Na2SO4+2HC1↑
Na2SO4+2HC1↑
②C +2H2SO4(浓) ![]() CO2↑+ 2SO2↑+2H2O
CO2↑+ 2SO2↑+2H2O
③Cu+2H2SO4(浓) ![]() CuSO4+ SO2↑+2H2O
CuSO4+ SO2↑+2H2O
④2FeO+4H2SO4(浓)=Fe2(SO4)3+SO2↑+4H2O
A. ①② B. ③④ C. ①③ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质间的转化,通过一步反应不能实现的是( )
A.CO2→Na2CO3
B.FeCl3→FeCl2
C.H2SiO3→Na2SiO3
D.S→SO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com