
【题目】设X、Y、Z代表3种短周期元素,已知:
①Ym-和Zn-两种离子是有相同的电子层结构
②X与Y可以形成原子个数比为1:1的化合物甲和2:1的化合物乙,甲、乙都是共价化合物
③X与Z形成原子个数比为1:1的化合物丙,其分子与乙的分子所含质子数相同。据此,填写下面空白:
(1)Ym-的离子结构示意图为_________,Z元素是___________
(2)化合物甲的电子式是____________
(3)Z单质与化合物乙反应的化学方程式是________________
(4)化合物丙与氢氧化钠溶液反应的离子方程式是_______________
【答案】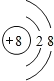 F
F ![]() 2F2+2H2O===4HF+O2 HF+OH-===F-+H2O
2F2+2H2O===4HF+O2 HF+OH-===F-+H2O
【解析】
Ym-和Zn-两种离子是有相同的电子层结构说明Y、Z元素同一周期;X与Y、X与Z均能形成化合物,则X应显正价;X与Y可以形成原子个数比为1:1的化合物甲和2:1的化合物乙,甲、乙都是共价化合物,满足该条件的有:
①N和O形成的NO和N2O,即X为N,Y为O;N2O所含质子数为22,则Z的质子数为22-7=15,为P元素,与“Y、Z元素同一周期”矛盾,故该假设不成立;
②H和O形成的H2O2和H2O,即X为H,Y为O;H2O质子数为10,则Z的质子数为10-1=9,为F元素,符合条件;
综上所述X为H,Y为O,Z为F。
(1)Ym-即O2-离子结构示意图为: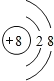 ;Z元素为F;
;Z元素为F;
(2)化合物甲为过氧化氢,其电子式为:![]() ;
;
(3)F2与水的反应方程式为:2F2+2H2O===4HF+O2;
(4)HF与氢氧化钠反应生成氟化钠和水,氢氟酸为弱酸,所以离子方程式为:HF+OH-===F-+H2O。


科目:高中化学 来源: 题型:
【题目】在一密闭容器中进行反应:2SO2(g)+O2(g) ![]() 2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.4mol/L、0.2mol/L、0.4mol/L,当反应达平衡时,可能存在的数据是
2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.4mol/L、0.2mol/L、0.4mol/L,当反应达平衡时,可能存在的数据是
A. SO2为0.8mol/L,O2为0.4mol/L
B. SO2为0.5mol/L
C. SO3为0.8mol/L
D. SO2、SO3一定均为0.3mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定溶液中一定能大量共存的离子组是
A.pH=1的无色溶液中:NH![]() 、Na+、Fe3+、
、Na+、Fe3+、![]()
B.含有大量Ba2+的溶液中:Na+、K+、HCO![]() 、NO
、NO![]()
C.中性溶液中:K+、Fe3+、Cl-、![]()
D.Na2S溶液中:![]() 、K+、Fe3+、Cl-
、K+、Fe3+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:101 kPa时,1molH2完全燃烧生成液态水,放出285.8 kJ的热量;1molCH4完全燃烧生成液态水和CO2,放出890.3 kJ的热量。下列能表示燃烧热的热化学方程式是
A.CH4(g)+2O2(g)![]() CO2(g)+2H2O(l) ΔH=890.3 kJ
CO2(g)+2H2O(l) ΔH=890.3 kJ
B.CH4(g)+2O2(g)![]() CO2(g)+2H2O(l) ΔH=+890.3 kJ·mol1
CO2(g)+2H2O(l) ΔH=+890.3 kJ·mol1
C.CH4(g)+2O2(g)![]() CO2(g)+2H2O(g) ΔH=890.3 kJ·mol1
CO2(g)+2H2O(g) ΔH=890.3 kJ·mol1
D.H2(g)+![]() O2(g)
O2(g)![]() H2O(l) ΔH=285.8 kJ·mol1
H2O(l) ΔH=285.8 kJ·mol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.92g铜投入一定量的浓硝酸中,铜完全溶解,生成的气体颜色越来越浅,共收集到标况下672mL气体。将盛有此气体的容器倒扣在水中,通入标况下一定体积的O2恰好使气体完全溶于水中,则通入的O2的体积是( )
A.336mLB.168mLC.224mLD.112mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学按图所示的装置进行电解实验 下列说法正确的是 ( )
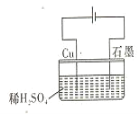
A.电解过程中,铜电极上有H2产生
B.电解初期,总反应方程式为:Cu+H2SO4 ![]() CuSO4+H2
CuSO4+H2
C.电解一段时间后,石墨电极上有O2产生
D.整个电解过程中,H+的浓度不断增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作规范且能达到实验目的的是
选项 | 实验目的 | 操作 |
A | 取20.00 mL盐酸 | 在25 mL酸式滴定管中装入盐酸。调整初始读数为5.00 mL后,将剩余盐酸全部放入锥形瓶中 |
B | 测量饱和Na2CO3溶液的pH值 | 用蒸馏水湿润pH试纸,放入Na2CO3溶液中,观察pH试纸颜色,并与比色卡对比,读出pH值 |
C | 制取纯净的FeCl 3固体 | 加热蒸干FeCl3溶液 |
D | 验证Ksp[Cu(OH)2]< Ksp[Mg(OH)2] | 将0.1 mol·L-1 MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1 mol/L CuSO4溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是日常生活中最常见的金属,某班同学在学习铁的知识时,有下列问题:
问题1:铁为何称为黑色金属?
问题2:CuO在高温下可分解为 Cu2O和O2,Fe2O3在高温下可分解为FeO和O2吗?
(1)对于问题1,同学们上网查找,有两种解释:
A.因为在铁表面上有黑色的铁的氧化物,所以叫黑色金属
B.因为铁的粉末为黑色,铁的氧化物也均为黑色,所以叫黑色金属
①你认为正确的说法是__________。
②若有一黑色粉末,如何鉴别是铁粉,还是Fe3O4?______________________________________。
③若有一黑色粉末,为铁和四氧化三铁的混合物,如何证明其中有Fe3O4(只要求简述实验方法)?____________________________________。
(2)对于问题2,同学们准备实验探究,他们设想了两种方法:
A.将三氧化二铁高温灼烧,看灼烧前后颜色是否变化。
B.将三氧化二铁高温灼烧,看灼烧前后质量是否变化。
①实验中应将Fe2O3放在__________(填仪器名称)中灼烧。
②方法A中,如果高温灼烧后颜色由__________变为__________,说明Fe2O3确实发生了变化。能说明生成的一定为FeO吗?__________,理由是________________________。
③方法B中,如果发生了预期的反应,固体高温灼烧前后质量比应为________,但是,实验结果固体灼烧前后质量比为30∶29,则高温灼烧后生成物是____________________。
④比较两种方法,你认为较好的方法是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知一种c(H+)=1×10-3mol/L的酸和一种c(OH-)=1×10-3mol/L的碱溶液等体积混合后溶液呈酸性,其原因可能是( )
A.浓的强酸和稀的强碱溶液反应
B.浓的弱酸和稀的强碱溶液反应
C.等浓度的强酸和弱碱溶液反应
D.生成了一种强酸弱碱盐
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com