
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | 明矾水解时产生具有吸附性的胶体粒子 | 明矾可作自来水消毒 |
| B | Fe3+有氧化性 | FeCl3溶液可用于溶解回收旧电路板 中的铜 |
| C | NH4Cl受热分解 | 加热可将Ca(OH)2和NH4Cl固体混合物分离 |
| D | SO2具有氧化性 | SO2可用于漂白纸浆 |
| A. | A | B. | B | C. | C | D. | D |
分析 A、明钒水解生成的氢氧化铝胶体吸附悬浮杂质,可以净水但无消毒作用;
B、铁离子具有氧化性可以氧化铜,溶解电路板上的金属铜回收;
C、氢氧化钙和氯化铵加热会发生反应生成氨气、氯化钙和水;
D、SO2可用于漂白纸浆是利用二氧化硫的漂白性.
解答 解:A、明钒水解生成的氢氧化铝胶体吸附悬浮杂质,可以净水但无消毒作用,Ⅰ正确,Ⅱ错误,二者无因果关系,故A错误;
B、铁离子具有氧化性可以氧化铜,溶解电路板上的金属铜回收,2Fe3++Cu=2Fe2++Cu2+,Ⅰ、Ⅱ都正确且两者间具有因果关系,故B正确;
C、氢氧化钙和氯化铵加热会发生反应生成氨气、氯化钙和水,不能用来除杂,Ⅰ正确,Ⅱ错误,二者无因果关系,故C错误;
D、SO2可用于漂白纸浆是利用二氧化硫的漂白性,Ⅰ正确,Ⅱ正确,但二者无因果关系,故D错误.
故选B.
点评 本题考查了盐类水解的原理分析,物质性质的分析判断,注意二氧化硫的漂白性与氧化性、还原性的区别,题目难度中等.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 该反应中,钠作为还原剂,二氧化碳作为氧化剂 | |
| B. | 生成的金刚石是氧化产物 | |
| C. | 该反应属于置换反应 | |
| D. | 还原性Na大于C |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1L该溶液中含溶质98g | |
| B. | 从10mL 该溶液中取出5mL后,剩余溶液的浓度为0.5mol•L-1 | |
| C. | 将4.9g浓硫酸加入盛有50mL蒸馏水的烧杯中充分溶解就可配得该浓度的硫酸溶液 | |
| D. | 该浓度的硫酸具有酸的通性,但不具有强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 足量硫化氢气体通入硫酸铁溶液中:H2S+Fe3+═Fe2++S↓+2H+ | |
| B. | 足量铁与稀硝酸反应:Fe+4H++NO3-═Fe2++4H2O+NO↑ | |
| C. | 醋酸溶液与纯碱反应:CO32-+2H+═H2O+CO2↑ | |
| D. | 等物质的量的Ba(OH)2与NaHSO4在溶液中反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH电离程度变大 | B. | 溶液pH减小 | ||
| C. | 溶液的导电能力减弱 | D. | 溶液中c(H+)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
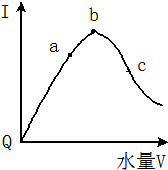 在室温下,冰醋酸加水稀释过程中,溶液导电能力I随加入水量(V表示体积)的变化曲线如图所示,请回答:
在室温下,冰醋酸加水稀释过程中,溶液导电能力I随加入水量(V表示体积)的变化曲线如图所示,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 侯氏制碱、肥皂的制取工艺过程中均应用了物质溶解度的差异 | |
| B. | 可用蘸浓氨水的棉棒检验输送氯气的管道是否漏气 | |
| C. | 石油分馏、煤的气化、海水晒盐、碱去油污、花生中提取花生油等过程都是物理变化 | |
| D. | 利用钠的性质制造的高压钠灯,可发出射程远、透雾能力强的黄光 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com