
合成氨是人类科学技术上的一项重大突破,其反应原理为:N2(g)+3H2(g)⇌2NH3(g)+Q(Q>0)
一种工业合成氨的简易流程图如下:
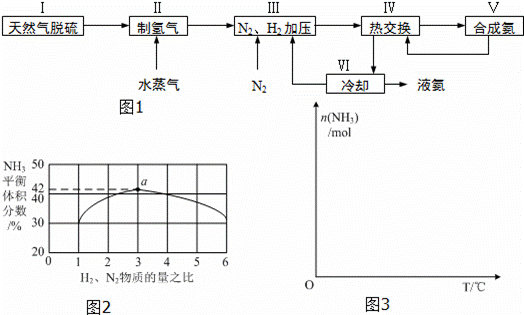
完成下列填空:
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS.一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生.NH4HS的电子式是 ,写出再生反应的化学方程式: .NH3的沸点高于H2S,是因为NH3分子之间存在着一种比 更强的作用力.
(2)室温下,0.1mol/L的氯化铵溶液和0.1mol/L的硫酸氢铵溶液,酸性更强的是 .已知:H2SO4:Ki2=1.2×10﹣2NH3•H2O:Ki=1.8×10﹣5.
(3)图2表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系.根据图中a点数据计算N2的平衡体积分数: (答案用小数表示,保留3位有效数字).
(4)依据温度对合成氨反应的影响,在图3坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图.
(5)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号) .简述本流程中提高合成氨原料总转化率的方法: .
考点: 工业合成氨;化学平衡的调控作用.
专题: 化学平衡专题.
分析: (1)NH4HS的电子式是 ;H2S杂质常用氨水吸收,产物为NH4HS,一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,反应过程中生成一水合氨,依据原子守恒和电子守恒配平书写化学方程式;NH3分子间存在氢键,所以NH3的沸点高于H2S;
;H2S杂质常用氨水吸收,产物为NH4HS,一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,反应过程中生成一水合氨,依据原子守恒和电子守恒配平书写化学方程式;NH3分子间存在氢键,所以NH3的沸点高于H2S;
(2)硫酸氢铵中的硫氢根离子第二步电离程度Ki2=1.2×10﹣2,非常的大,所以硫酸氢铵溶液的酸性强同浓度的氯化铵;
(3)依据反应特征N2+3H2=2NH3,反应前后气体体积减小为生成氨气的体积,相同条件下,气体体积比等于气体物质的量之比,图象分析可知平衡状态氨气体积含量42%,设平衡混合气体体积为 100,氨气为体积42,计算反应的氮气,依据气体体积比计算原混合气体中氮气体积,得到平衡状态下氮气体积分数;
(4)合成氨的反应是放热反应,开始反应,氨气物质的量增大,达到平衡状态,继续升温,平衡逆向进行,氨气物质的量减小,据此画出变化图象;
(5)依据反应是气体体积减小的放热反应,结合平衡移动原理分析判断;
解答: 解:(1)NH4HS的电子式是 ;H2S杂质常用氨水吸收,产物为NH4HS,一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,反应过程中生成一水合氨,依据原子守恒和电子守恒配平书写化学方程式为:2NH4HS+O2
;H2S杂质常用氨水吸收,产物为NH4HS,一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,反应过程中生成一水合氨,依据原子守恒和电子守恒配平书写化学方程式为:2NH4HS+O2 2NH3•H2O+2S;
2NH3•H2O+2S;
;NH3分子间存在氢键,所以NH3的沸点高于H2S,
故答案为: ;2NH4HS+O2
;2NH4HS+O2 2NH3•H2O+2S;分子间作用;
2NH3•H2O+2S;分子间作用;
(2)硫酸氢铵中的硫氢根离子第二步电离程度Ki2=1.2×10﹣2,非常的大,而氯化铵是水解呈酸性,所以硫酸氢铵溶液的酸性强同浓度的氯化铵,
故答案为:硫酸氢铵;硫酸氢铵中的硫氢根离子第二步电离程度Ki2=1.2×10﹣2,非常的大,大于铵根离子水解产生的酸性;
(3)依据反应特征N2+3H2=2NH3 △V
1 3 2 2
平衡体积 V V
即反应前后气体体积减小为生成氨气的体积,相同条件下,气体体积比等于气体物质的量之比,图象分析可知平衡状态氨气体积含量42%,设平衡混合气体体积为100,氨气为体积42,则反应前气体体积100+42=142,氮气和氢气按照1:3混合,氮气体积=142× =35.5,依据化学方程式计算反应的氮气体积为21,平衡状态氮气为35.5﹣21=14.5,则氮气体积分数为14.5%;
=35.5,依据化学方程式计算反应的氮气体积为21,平衡状态氮气为35.5﹣21=14.5,则氮气体积分数为14.5%;
故答案为:14.5%;
(4)合成氨的反应是放热反应,开始反应,氨气物质的量增大,达到平衡状态,继续升温,平衡逆向进行,氨气物质的量减小,画出的图象为:
 ,故答案为:
,故答案为: ;
;
(5)分析流程合成氨放热通过Ⅳ热交换器加热反应混合气体,使反应达到所需温度,提高合成氨原料总转化率,依据平衡移动原理分析,分离出氨气促进平衡正向进行,把平衡混合气体中氮气和氢气重新循环使用,提高原理利用率;
故答案为:Ⅳ;分离液氨,未反应的氮气和氢气循环使用.
点评: 本题考查了化学平衡影响因素分析,平衡计算应用,注意反应特征的计算应用,图象绘制,掌握基础是关键,题目难度较大.


 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
反应 X(气)+Y(气)⇌2Z(气)+Q(Q>0),在一定条件下,反应物Y的转化率与反应时间(t)的关系如图所示.若使曲线a变为曲线b可采取的措施是()
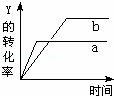
A. 加入催化剂 B. 降低温度 C. 增大压强 D. 增大Y的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
用如图装置(夹持、加热装置已略)进行实验,由②中现象,不能证实①中反应发生的是
①中实验②中现象()
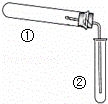
A. 铁粉与水蒸气加热 肥皂水冒泡
B. 加热NH4Cl和Ca(OH)2混合物 酚酞溶液变红
C. NaHCO3固体受热分解 澄清石灰水变浑浊
D. 石蜡油在碎瓷片上受热分解 Br2的CCl4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值.下列说法正确的是()
A. 1 mol甲苯含有C﹣H键数目为8NA
B. 1 mol丙烯酸中含有双键的数目为NA
C. 由a g C2H4和C3H6组成的混合物中所含共用电子对数目为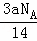
D. 在过氧化钠跟水的反应中,每生成2.24 L氧气,转移电子的数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
多硫化钙[CaSx( x≤5)]、硫代硫酸钙组成的混合物称为石硫合剂,它是一种很好的植物杀虫剂,是由硫磺跟石灰、水等反应所得.不同比例的硫磺跟石灰在水溶液中反应,可生成不同的多硫化钙与硫代硫酸钙.
3Ca(OH)2+8S 2CaS3+CaS2O3+3H2O;3Ca(OH)2+6S
2CaS3+CaS2O3+3H2O;3Ca(OH)2+6S 2CaS2+CaS2O3+3H2O
2CaS2+CaS2O3+3H2O
完成下列计算:
(1)硫磺溶解在硫化钠溶液中生成一种多硫化物,该多硫化物中硫元素的质量分数为0.736,则该Na2Sx中x=4.
(2)取某石硫合剂(假如只含两种含硫化合物)250mL(密度为1.12g/cm3)通入足量CO2使其快速分解.原理如下:Sx2﹣+2H2O+2CO2→(x﹣1)S↓+H2S↑+2HCO3﹣;S2O32﹣+H2O+CO2→HSO3﹣+HCO3﹣+S↓
完全反应后共收集到气体1.12升(标准状况)(忽略气体在溶液中的溶解),则该石硫合剂中多硫化钙的物质的量浓度为 ;硫代硫酸钙的质量分数为 .(答案用小数表示,保留2位有效数字)
(3)如果把生石灰、硫磺和水按质量比7:16:70的配比完全反应后,只生成两种含硫的化合物,则该石硫合剂中多硫化钙与硫代硫酸钙的物质的量之比是 ;多硫化钙的化学式是 .
(4)现有生石灰50.4g、硫磺96g、水504g恰好完全反应生成三种多硫化钙,除生成CaS4之外还有二种多硫化钙.请推算这二种多硫化钙可能的物质的量之比 (写出推理过程).
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各变化中属于原电池的反应的是( )
|
| A. | 在空气中金属铝表面迅速氧化形成保护层 |
|
| B. | 从海水中通过化学方法得到金属镁 |
|
| C. | 红热的铁丝与冷水接触,表面表成蓝黑色保护层 |
|
| D. | 锌和稀硫酸反应时,加入少量的CuSO4溶液可使反应加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中溶质的物质的量浓度为1mol•L﹣1的是( )
-A.-将58.5 g NaCl溶解于1 L水中配成的溶液
-B.-含K+为2 mol的K2SO4溶液
-C.-将0.5 mol•L﹣1的NaNO3溶液100 mL加热蒸发掉50 g水的溶液
-D.-将250 g 胆矾溶于水并配成1 L溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)0.25molH3PO4分子中含有氢原子的物质的量是 ,含有氧原子数目为 .
(2)0.3molH2O与0.4molCO2的物质的量之比为 ,所含分子数目之比为 ,所含氧原子数目之比为 .
(3)19g某二价金属氯化物(ACl2)中含有0.4mol Cl﹣,则ACl2的摩尔质量是 ,A的相对原子质量是 ,ACl2的化学式是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com