
下列叙述中正确的是( )
|
| A. | 周期表中第VA族元素的最高价氧化物对应水化物的化学式均为H3RO4 |
|
| B. | O22﹣与S2﹣具有相同的质子数和电子数 |
|
| C. | 所有主族元素的简单离子所带电荷数与其族序数相等 |
|
| D. | 氕化锂、氘化锂、氚化锂可以作为“长征2号”火箭发射的重要燃料,LiH、LiD、LiT的化学性质不同 |
考点:
元素周期表的结构及其应用;同位素及其应用;质子数、中子数、核外电子数及其相互联系.
分析:
A、ⅤA族元素,最高价为+5价,N元素的最高价氧化物对应水化物的化学式为HNO3;
B、O22﹣与S2﹣的质子数均为16和电子数均为18;
C、阴离子所带电荷数不一定等于其族序数;
D、H、D、T核外同位素,LiH、LiD、LiT的化学性质几乎完全相同.
解答:
解:A、ⅤA族元素,最高价为+5价,N元素的最高价氧化物对应水化物的化学式为HNO3,故A错误;
B、O22﹣与S2﹣的质子数16和电子数为18,所以两种微粒具有相同的质子数和电子数,故B正确;
C、阴离子所带电荷数不一定等于其族序数,如:S2﹣、Cl﹣,故C错误;
D、H、D、T核外同位素,LiH、LiD、LiT的化学性质几乎完全相同,故D错误,
故选B.
点评:
本题考查原子结构与性质,难度不大,注意C选项中阴离子所带电荷数可能等于其族序数,如氢负离子,D选项中三种化学式表示的物质实质是一种物质.


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
实验室配制欲配制480mL4.0mol•L﹣1的NaOH溶液.根据配置溶液的具体过程回答下列问题:
(1)配制该溶液应选用的玻璃仪器主要有:天平、量筒、烧杯、玻璃棒、 、 .
(2)用托盘天平称取 g固体NaOH.
(3)将称好的NaOH固体放至500mL的大烧杯中,倒入蒸馏水,用玻璃棒搅拌至完全溶解.待冷却至室温后,将烧杯中的溶液用玻璃棒引流转移至容量瓶.
(4)用少量蒸馏水洗涤烧杯2﹣3次,并将每次洗涤的溶液都注入容量瓶,轻轻晃动容量瓶,使溶液混和均匀.
(5)定容.滴加蒸馏水至液面与刻度线相切.盖好瓶塞,摇匀.
(6)以下因素会造成实验结果偏低的是 (不一定是单选,多选漏选均不得分).
A.定容时观察液面仰视 B.定容时观察液面俯视
C.有少量NaOH溶液残留在烧杯中 D.容量瓶中原来有少量蒸馏水
(7)实验室中加热灼烧固体时,被加热的固体应盛在什么仪器中,写出该仪器的名称 .
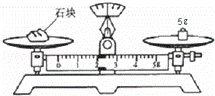
(8)某同学用托盘天平称量的某石块的质量,读数如图所示,其读数的准确值是 g.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验现象不能说明相关结论的是( )
A.向Al(OH)3沉淀中滴加NaOH溶液或盐酸,沉淀均消失,说明Al(OH)3是两性氢氧化物
B.将金属钠投入冷水中,钠熔为小球,说明钠与水的反应为放热反应且钠的熔点低
C.向AgCl浊液中滴加Na2S溶液,白色沉淀变成黑色,说明AgCl溶解度比Ag2S大
D.将铜与浓硫酸共热,产生使石蕊溶液变红的气体,说明浓硫酸被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N-N为154,则断裂1 mol N-H键所需的能量(kJ)是
A.391 B.516 C.658 D.194

查看答案和解析>>
科目:高中化学 来源: 题型:
关于元素周期表和元素周期律的应用有如下叙述:其中正确的是( )
①元素周期表是同学们学习化学知识的一种重要工具;
②利用元素周期表可以预测新元素的原子结构和性质;
③利用元素周期表和元素周期律可以预言新元素;
④利用元素周期表可以指导寻找某些特殊的材料.
|
| A. | ①②③④ | B. | ②③④ | C. | ③④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
1)有下列几种物质
A.金刚石和石墨 B.C2H6和C5H12 C.C2H4和C2H6
D.CH3CH2CH2CH3和CH3CH(CH3)2 E.35Cl和37Cl
属于同分异构体的是 ;属于同素异形体的是 ;属于同系物的是 ;属于同位素的是 .
(2)两种粒子的核外电子排布相同,核电荷数不同,则它们可能是
A.两种不同元素的原子
B.一定是两种不同的离子
C.同一元素的原子和离子
D.两种不同元素的原子和离子.
查看答案和解析>>
科目:高中化学 来源: 题型:
镁化合物具有广泛用途,请回答有关镁的下列问题:
(1)单质镁在空气中燃烧的主要产物是白色的______________,还生成少量的______________(填化学式);
(2)CH3MgCl是一种重要的有机合成剂,其中镁的化合价是_____________,该 化合物水解的化学方程式为_________________;
化合物水解的化学方程式为_________________;
(3)下图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。
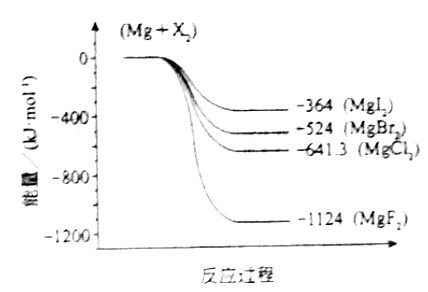
下列选项中正确的是_______________(填序号)。
①MgI2中Mg2+与I-间的作用力小于MgF2中Mg2+与F-间的作用力
②Mg与F2的反应是放热反应
③MgBr2与Cl2反应的△H<0
④化合物的热稳定性顺序为MgI2>MgBr2>MgCl2>MgF2
⑤MgF2(s)+Br2(l)=MgBr2(s)+F2(g)△H=+600kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。
(1)冶炼铜的反应为8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是___________(填元素符号)。
(2)上述冶炼过程产生大量SO2。下列处理方案中合理的是________(填代号)。
a.高空排放
b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO3
d.用浓硫酸吸收
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2: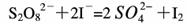
通过改变反应途径Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应催化的过程。________、___________(不必配平)
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
据以上信息回答下列问题:
a.除去Al3+的离子方程式是______________。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所选试剂为_____________。
证明炉渣中含有FeO的实验现象为___________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com