
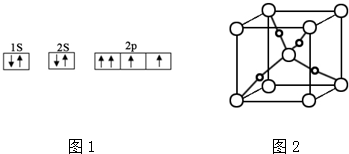
分析 (1)由图1电子轨道排布图可知,2p能级的其中1个轨道2个电子自旋方向相同,违背泡利原理;
(2)Cu2+ 含有空轨道,为中心离子,而NH3中的N原子含有孤对电子,NH3为配体;计算SO42-中S原子的孤对电子数、价层电子对数,确定其空间构型;
(3)甲醇分子间存在氢键,因此其沸点远大于乙烷的;甲醇分子中C原子形成4个σ键,没有孤对电子,杂化轨道数目为4;
(4)根据均摊法可知,晶胞中大球数目为2,小球数目为4,二者数目之比为1:2,由于为Cu2O晶胞的结构,故大球为O原子、小球为Cu原子,结合氧原子配位数确定.
解答 解:(1)由图1电子轨道排布图可知,2p能级的其中1个轨道2个电子自旋方向相同,违背泡利不相容原理,
故答案为:错误;违背泡利不相容原理;
(2)Cu2+ 含有空轨道,为中心离子,接受电子,而NH3中的N原子含有孤对电子,NH3为配体;SO42-中S原子的孤对电子数=$\frac{6+2-2×4}{2}$=0、价层电子对数=4+0=4,其空间构型为正四面体,
故答案为:氮原子(或N);Cu2+;正四面体;
(3)甲醇分子间存在氢键,因此其沸点远大于乙烷的;甲醇分子中C原子形成4个σ键,没有孤对电子,杂化轨道数目为4,碳原子采取sp3杂化,
故答案为:甲醇分子间存在氢键,因此其沸点远大于乙烷;sp3;
(4)根据均摊法可知,晶胞中大球数目为8×$\frac{1}{8}$+1=2,小球数目为4,二者数目之比为1:2,由于为Cu2O晶胞的结构,故大球为O原子、小球为Cu原子,氧原子配位数为4,则该晶胞中,Cu+的配位数是2,
故答案为:2.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、配合物、杂化方式判断、氢键、晶胞有关计算等,注意掌握判断原子轨道杂化方式的方法,试题培养了学生分析、理解能力及灵活应用能力,题目难度中等.


 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4种 | B. | 8种 | C. | 11种 | D. | 12种 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
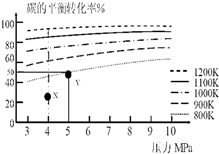
| A. | 上述正反应为吸热反应 | |
| B. | 在5MPa、800K时,该反应的平衡常数为$\frac{{V}^{2}}{{a}^{2}}$L2•mol-2 | |
| C. | 在4MPa、1200K时,图中X点υ(H2)正>υ(H2)逆 | |
| D. | 工业上维持6MPa 1000K而不采用10MPa1000K,主要是因为前者碳的转化率高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
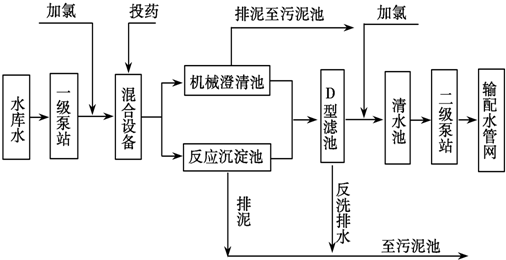
| A. | 若用FeSO4作混凝剂,最终铁将以Fe(OH)2形式进入反应沉淀池 | |
| B. | 投药时常加入适量的石灰,是为了除去水中Mg2+、HCO3-等 | |
| C. | 自来水生产中,前面加氯起消毒杀菌作用,后面加氯是保持水中有效氯的含量,防止自来水二次污染 | |
| D. | 用ClO2消毒自来水,消毒效率是等质量氯气的2.63倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 0.002 5 mol•L-1 | B. | 0.001 mol•L-1 | C. | 0.000 3 mol•L-1 | D. | 0.003 5 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “地沟油”禁止食用,但可以用来制肥皂 | |
| B. | 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈 | |
| C. | 纤维素在人体内可水解为葡萄糖,故可作人类的营养物质 | |
| D. | 葡萄中的花青素在碱性环境下显蓝色,故可用苏打粉检验假红酒 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com