
某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。
实验一 配制并标定醋酸溶液的浓度
取冰醋酸配制250 mL 0.2 mol·L-1的醋酸溶液,用0.2 mol·L-1的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题:
(1)配制250 mL 0.2 mol·L-1醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、__________________和______________。
(2)为标定某醋酸溶液的准确浓度,用0.200 0 mol·L-1的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
则该醋酸溶液的准确浓度为____________________。(保留小数点后四位)
实验二 探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋酸溶液的pH,结果如下:
醋酸溶液浓度(mol·L-1) | 0.001 0 | 0.010 0 | 0.020 0 | 0.100 0 | 0.200 0 |
pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
回答下列问题:
(1)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是______________________________________
(2)从表中的数据,还可以得出另一结论:随着醋酸溶液浓度的减小,醋酸的电离程度________(填“增大”“减小”或“不变”)。
实验三 探究温度对醋酸电离程度的影响
请你设计一个实验完成该探究,请简述你的实验方案
________________________________________
实验一 (1)胶头滴管 250 mL容量瓶
(2)0.200 0 mol·L-1
实验二 (1)0.010 0 mol·L-1醋酸溶液的pH大于2或醋酸溶液稀释10倍时,pH的变化值小于1
(2)增大
实验三 用pH计测定相同浓度的醋酸溶液在几种不同温度时的pH
【解析】实验一:(2)从4次平行实验的数据可以看出,第三次实验数据不准确,不能使用,故采用1、2、4三次实验数据的平均值求解。由c1V1=c2V2可得醋酸溶液的准确浓度为0.200 0 mol·L-1。实验二:(1)浓度为0.100 0 mol·L-1的醋酸溶液pH=2.88>1,可以证明醋酸溶液存在电离平衡,说明醋酸是弱酸,也可通过比较浓度为0.010 0 mol·L-1和0.001 0 mol·L-1两溶液的pH变化不到1来证明醋酸是弱酸。(2)由表中数据知醋酸溶液稀释10倍,pH增加不到1,证明稀释后c(H+)大于原来浓度的1/10,从而说明随着醋酸溶液浓度的减小,电离程度增大。实验三:可利用pH计测定同浓度不同温度下醋酸溶液的pH,从而得出温度对电离程度的影响。


科目:高中化学 来源:2014年高考化学题型冲刺练习 化学基本概念、解决化学与STSE问题(解析版) 题型:选择题
下列说法不正确的是( )
A.化学变化不产生新元素,产生新元素的变化不是化学变化
B.根据分散质微粒直径大小可以将分散系分为溶液、浊液和胶体
C.向25 mL沸水中逐滴加入2 mL FeCl3饱和溶液,继续煮沸可以制得Fe(OH)3胶体
D.某微粒的电子数等于质子数,则该微粒可能是一种分子或一种离子
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习专练2 阿伏加德罗常数的判断练习卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数的值。下列叙述正确的是( )。
A.42 g C3H6中含有的共用电子对数目为8 NA
B.电解饱和食盐水时,当0.1 mol NaCl反应时,转移的电子数为0.1 NA
C.常温常压下,22.4 L N2和O2的混合气体中含有的分子数目为NA
D.1 L 0.01 mol·L-1 KAl(SO4)2溶液中含有的阳离子数目为0.02 NA
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习专练2 阿伏加德罗常数的判断练习卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的数值,下列说法正确的是( )。
A.1 mol·L-1 NaCl溶液含有NA个Na+
B.1 mol Cu和足量稀硝酸反应产生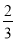 NA个NO分子
NA个NO分子
C.1 L 0.1 mol·L-1氨水含有0.1NA个OH-
D.1 mol Fe2+与足量的H2O2溶液反应,转移2NA个电子
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习专练1 化学实验仪器的创新使用练习卷(解析版) 题型:选择题
按图装置通入X气体,并在管P处点燃,实验结果是澄清石灰水变浑浊,则X、Y可能是 ( )。
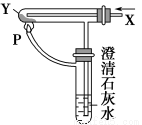
A.H2和Fe2O3
B.CO和CuO
C.H2和Na2CO3
D.CO和Na2CO3
查看答案和解析>>
科目:高中化学 来源:2014年高中化学鲁科版选修四第3章 物质在水溶液中的行为练习卷(解析版) 题型:选择题
下列各组数据中,其比值为2∶1的是( )
A.氨水与(NH4)2SO4溶液混合后pH=7的溶液中,[NH ]∶[SO
]∶[SO ]
]
B.相同温度下,0.2 mol·L-1乙酸溶液与0.1 mol·L-1乙酸溶液中,[H+]之比
C.Na2CO3溶液中,[Na+]∶[CO ]
]
D.pH=12的Ba(OH)2溶液与pH=12的KOH溶液中,c[Ba(OH)2]∶c(KOH)
查看答案和解析>>
科目:高中化学 来源:2014年高中化学鲁科版选修四第3章 物质在水溶液中的行为练习卷(解析版) 题型:选择题
下列各组溶液中,用括号内的试剂及物质间相互反应不能鉴别的一组是( )
A.Ba(OH)2、KSCN、NaCl、Mg(NO3)2(FeCl3溶液)
B.NaNO3、NaHCO3、(NH4)2SO3、Na2SiO3(H2SO4溶液)
C.NH4Br、K2CO3、NaI、CaCl2(AgNO3溶液)
D.(NH4)3PO4、NaBr、CuSO4、AlCl3(KOH溶液)
查看答案和解析>>
科目:高中化学 来源:2014年高中化学鲁科版选修四第1章 化学反应与能量转化练习卷(解析版) 题型:选择题
某蓄电池放电、充电时的反应为Fe+Ni2O3+3H2O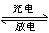 Fe(OH)2+2Ni(OH)2
Fe(OH)2+2Ni(OH)2
下列推断中正确的是( )
①放电时,Fe为正极,Ni2O3为负极 ②充电时,阴极上的电极反应式是:Fe(OH)2+2e-=Fe+2OH- ③充电时,Ni(OH)2为阳极 ④该蓄电池的电极必须是浸在某种碱性电解质溶液中
A.①②③ B.①②④C.①③④ D.②③④
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四专题3 溶液中的离子反应练习卷(解析版) 题型:填空题
某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。
实验一:配制并标定醋酸溶液的浓度
取冰醋酸配制250 mL 0.2 mol/L的醋酸溶液,用0.2 mol/L的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对稀释后醋酸溶液的浓度进行标定。回答下列问题:
(1)配制250 mL 0.2 mol/L醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、________和________。
(2)为标定某醋酸溶液的准确浓度,用0.2000 mol/L的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.50 | 19.95 |
则该醋酸溶液的准确浓度为__________(保留小数点后四位)。
实验二:探究浓度对醋酸电离程度的影响
用pH计测定25°C时不同浓度的醋酸的pH,结果如下:
醋酸浓度(mol/L) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
回答下列问题:
(3)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是
____________________________________________________
(4)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度________(填“增大”、“减小”或“不变”)。
(5)实验三:该同学用pH计测定相同浓度的醋酸在几种不同温度时的pH,该同学的实验目的是:____________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com