
����Ŀ��M��ʾĦ��������NA��ʾ�����ӵ�������Vm��ʾ����Ħ�����������ʾ���ʵ�����������������λΪgcm-3����ʾ��Һ���ܶȡ�����˵���в���ȷ���ǣ� ��
A.����Ħ�������Ͱ����ӵ��������Լ���ó�ij������ӵ�������![]()
B.��������Ħ������Ͱ����ӵ��������Լ���ó���������ij������ӵĴ�С��![]()
C.����Ħ������������Ħ��������Լ���ó���������ij������ܶȣ�![]()
D.�������ʵ�����������Ħ����������Һ���ܶȿ��Լ����ij��Һ�����ʵ���Ũ�ȣ�![]()
���𰸡�B
��������
A.1mol���������ΪMg�����к��еķ�����ĿΪNA�����������ӵ�����m(����)=![]() g��A��ȷ��
g��A��ȷ��
B.��������ںܴ�Ŀռ��˶�������֮��ļ���ܴ���˲��ܸ�������Ħ������Ͱ����ӵ������������������ij������ӵĴ�С��B����
C.�����ܶȹ�ʽ���ɵ�������ܶ���=![]() ��C��ȷ��
��C��ȷ��
D.������Һ�����ʵ���Ũ�ȶ����֪����λ�������Һ�������е����ʵ����ʵ���Ϊ��Һ�����ʵ���Ũ�ȣ�����Һ�����ʵ���Ũ��c=![]() ��D��ȷ��
��D��ȷ��
�ʺ���ѡ����B��


 ���ɶ��ȫ���ƿؾ�ϵ�д�
���ɶ��ȫ���ƿؾ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������֪ʶ����������⡣
(1)��ʵ��������ȡCl2�������ռ�Cl2��װ������ȷ����_______(����ĸ)��
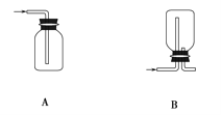
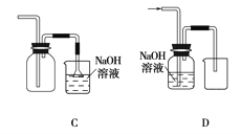
Ư���������ᷢ����Ӧ��������Ũ�Ȳ�ͬʱ��Ư���������Ϸ�����Ӧ�����Ͳ�ͬ��Ư����ϡ���ᷢ�����ֽⷴӦ����ǿƯ���ԣ���ѧ����ʽΪ_________��Ư����Ũ���ᷢ��������ԭ��Ӧ��������������ѧ����ʽΪ____________��
(2)ͼ1��ijͬѧ�Ʊ���ˮ��װ��ͼ��
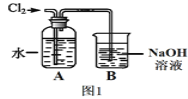
��װ��B�з�����Ӧ�Ļ�ѧ����ʽΪ__________________��
�ڼ���һƿ��ˮ�Ƿ��Ѿ���ȫ���ʣ���ѡ�õ��Լ���______________������ţ���
A����������ҺB����̪��Һ C��̼������Һ D����ɫʯ����Һ
����ˮ���ñ��ʵ���Ҫ��Ӧ����ʽ��ʾΪ______________________��
(3)��֪�����ԣ�Br2>Fe3���������廯������Һ��ͨ�����������ȱ�������������_______(�����ӷ���)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����T��ʱ����ag NH3��ȫ����ˮ���õ�VmL��Һ���������Һ���ܶ�Ϊ��g��cm-3�����ʵ���������Ϊw�����к�![]() �����ʵ���Ϊbmol��������������ȷ����(����)
�����ʵ���Ϊbmol��������������ȷ����(����)
A.���ʵ���������Ϊw��![]() ��100%
��100%
B.������Һ���ټ���VmLˮ��������Һ���ʵ�������������0.5w
C.��Һ��c(OH��)��![]() mol��L-1
mol��L-1
D.���ʵ����ʵ���Ũ��c��![]() mol��L��1
mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����KOH��Ca��OH��2�Ļ����Һ��c��OH����=0.1 molL��1��ȡ����Һ500 mL��������ͨ��CO2��ͨ��CO2�������V�������ɳ��������ʵ�����n���Ĺ�ϵ��ͼ��ʾ��ͼ�У�V1��Ϊ112 mL����״��������ͼ��V2��V3���������λΪmL���ֱ��ǣ� ��
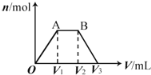
A. 560��672 B. 1008��1120 C. 2240��2352 D. 392��504
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ��������������ȷ����(����)
A. ��������ΪNA�Ķ�������Ͷ�����̼��������к��е�ԭ����Ϊ3NA
B. �κ������£�20 L �������еķ�������������ΪNA
C. �ڱ�״���£�2 g��������NA����ԭ��
D. ���ʵ�����ȵ��κ������ж�������ͬ��ԭ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ�������ʵ�鷽�����Է���KCl��BaCl2���ֹ�������Իش��������⣺
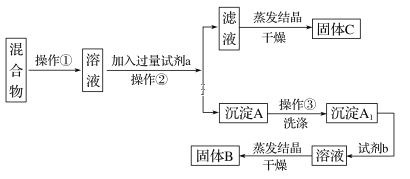
��ѡ�Լ���Na2SO4��Һ��K2CO3��Һ��K2SO4��Һ������
(1)�����ڵ�������__________���Լ�a��������__________(�ѧʽ)��
(2)�����Լ�b��������Ӧ�Ļ�ѧ����ʽΪ___________________��
(3)ϴ�ӳ���A�ķ���____________________��
(4)�÷����ܲ��ܴﵽʵ��Ŀ��__________�������ܣ�Ӧ��θĽ���(���ܣ����ʲ��ûش�)__________________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ѱ۳����ᣨ��Ҫ�����ᡢFe3+��Fe2+��TiO2+��Al3+���Ʊ����������[(NH4)2S2O8]��ͬʱ����TiO(OH)2�ļ�Ҫ�������£�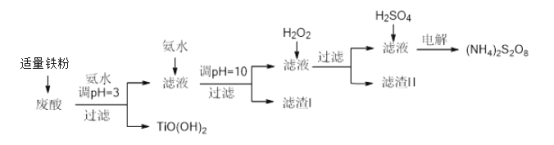
��֪��i.����������ȫ�����������������pH��
�������� | TiO2+ | Fe3+ | Fe2+ | Al3+ |
��ʼ������PH | 1.2 | 1.9 | 7.0 | 3.2 |
������ȫ��pH | 2.8 | 3.1 | 9.4 | 4.7 |
ii.pH>7ʱ��Fe2+��������Fe(II)��������[Fe(NH3)2]2+��
��ش��������⣺
��1��������������������______________________________________��
��2������TiO(OH)2�Ļ�ѧ����ʽ��________________________________��
��3������I���������о����е����ʵĻ�ѧʽ��___________________________��
��4������H2O2��Ŀ������������Fe(II)��������[Fe(NH3)2]2+����ƽ�������ӷ���ʽ��
2[Fe(NH3)2]2+ +____________+4H2O +H2O2 =___________ + 4NH3��H2O ��
��5�������£����Һ�к�������Ҫ������ʽ��pH�Ĺ�ϵ����ͼ��ʾ��
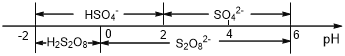
�������ŵ��������ҪΪHSO4-���������������Һ��pH��ΧΪ___________________________________
��6����֪Ksp[Al(OH)3]=3.2��10-34 ����pH=10 ʱ������Һ��c(Al3+)=______________
��7��25�棬pH=3��(NH4)2SO4��Һ�У�����2c(SO42-)- c(NH4+) =_______mol/L����ʽ���ɣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����0.1molL��1 NaOH��Һ����20mL0.1molL��1CH3COOH��Һ�У���������Һ�������V���ͻ��Һ��pH��ϵ������ͼ��ʾ�����н�����ȷ���ǣ�������
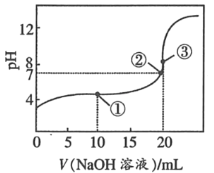
A.�ٵ�ʱ��c��CH3COO����+c��CH3COOH����c��Na+��
B.�������Ϣ٢ڢ��κ�һ�㣬��Һ�ж���c��Na+��+c��H+����c��OH����+c��CH3COO����
C.�۵�ʱ������ǡ����ȫ��Ӧ����Һ����c��CH3COO������c��Na+����c��H+����c��OH����
D.�ζ������п��ܳ���c��H+����c��Na+����c��CH3COO������c��OH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��ͬ���ʵ������ơ�þ�������������ᷴӦʱ�ų������������Ϊ__________���ֱ�Ϊ0.3 mol���ơ�þ����Ͷ��100 mL 1 mol��L-1��������Һ�У����߲������������_______��
(2)��һ�������Ƶ��������ڳ���CO2���壬Ȼ��������ע��������NaOH��Һ�������ý����ܷ�ڡ�����һ��ʱ��ޱ��ڰ������ٹ�һ��ʱ����˵Ĺޱ����¹��������ޱ��ڰ������ԭ����_____________�����ӷ���ʽ����Ϊ____________________�����ٹ����ԭ����________________�����ӷ���ʽ����Ϊ________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com