
| A. | c(CO32-) | B. | c(Mg2+) | C. | c(H+) | D. | Ksp(MgCO3) |
分析 MgCO3固体的溶液中存在溶解平衡:MgCO3(s)?Mg2+(aq)+CO32-(aq),加入少量稀盐酸,发生CO32-+H+=HCO3-或CO32-+2H+=CO2+H2O,平衡正向移动,以此解答该题.
解答 解:MgCO3固体的溶液中存在溶解平衡:MgCO3(s)?Mg2+(aq)+CO32-(aq),加入少量稀盐酸可与CO32-促使溶解平衡正向移动,故溶液中c(CO32-)减小,c(Mg2+)及c(H+)增大,Ksp(MgCO3)只与温度有关,不变,只有A正确.
故选A.
点评 本题考查难溶电解质的溶解平衡,为高频考点,侧重于学生的分析能力的考查,注意把握物质的性质以及平衡移动的影响因素,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 100 mL 1 mol•L-1的NaHCO3溶液中,含有HCO3-与CO32-的数目之和为0.1 NA | |
| B. | 用惰性电极电解MgCl2溶液,导线中流过2NA个e-时,生成24 g Mg | |
| C. | 标准状况下,11.2 L C2H6中含有极性键的数目为3.5NA | |
| D. | 常温常压下,20 g H218O中含有的中子数目为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作和现象 | 结论 | |
| A | 向用盐酸酸化的FeCl2溶液的试管中加入少量NaNO2溶液,在管口观察到红棕色气体 | 主要原因是:H++NO2-═HNO2, 2HNO2═NO↑+NO2↑+H2O |
| B | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2浊液,加热,没有红色沉淀生成. | 淀粉没有水解成葡萄糖 |
| C | 向阿司匹林(乙酰水杨酸)中加足量饱和NaHCO3溶液,有大量气泡产生. | 阿司匹林彻底水解 |
| D | 向1mL1.0mol•L-1AlCl3溶液中滴加2mL10% NH4F溶液,再滴加1mL 3.0mol•L-1NH3•H2O溶液,无沉淀生成. | Al3+更易与F-结合成AlF63- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生活中的玻璃、陶瓷、水泥属于无机硅酸盐材料,其生产原料都需要使用石灰石 | |
| B. | 居室装修材料如化纤地毯、三合板、花岗岩等均会释放出污染空气的甲醛气体 | |
| C. | 侯氏制碱、肥皂的制取工艺过程中均应用了物质溶解度的差异 | |
| D. | 某雨水样品放置一段时间后pH由4.68变为4.28,是因为吸收了CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
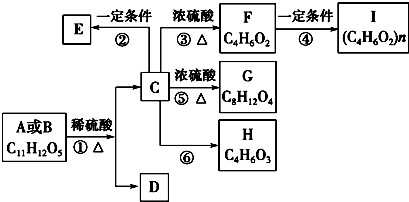
 .
.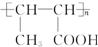
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Zn为电池的负极 | |
| B. | 正极反应式为2FeO42-+10H++6e-=Fe2O3+5H2O | |
| C. | 该电池放电过程中电解质溶液浓度不变 | |
| D. | 电池工作时OH-向负极迁移 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
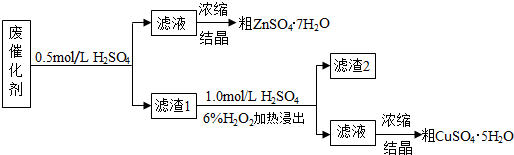

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
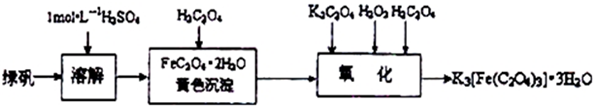
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 氢键X-H…Y | 键能kJ.mol-1 |
| (HF)n | D-H…F | 28.1 |
| 冰 | O-H…O | 18.8 |
| (NH3)n | N-H…N | 5.4 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com