
若过程I与过程II温度相同,则关于反应N2O4(g)2NO2 (g)在下列过程中发生的变化描述正确的是
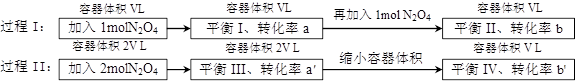
A. a' < b'、a>b B.在平衡I向平衡II过渡的过程中,v(逆) < v(正)
C.a' > a、b'<b D.平衡II与平衡IV中N2O4的质量分数相等
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源:2012-2013学年陕西省宝鸡市高三第三次模拟理综化学试卷(解析版) 题型:填空题
用化学反应原理相关知识同答
I.根据下表所示化学反应与数据关系回答下列问题:

(1)反应①是 (填“吸热"或“放热”)反应。
(2)根据反应①与②可推导出同温下K1、K2与K3之间的关系,则K3= (用K1、K2表示)。
(3)若反应③的逆反应速率与时间的关系如图所示:

①反应在t1、t3、t7时都达到了平衡,若t2时只改变了一种外界条件j试判断:改变的条件可能是 。
②若t4时降压,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系曲线。
II.请根据醋酸的电离平衡回答下列问题:
(1)常温下,0.1mol/L 的CH3COOH溶液中有l%的CH3COOH分子发生电离,则溶液的pH= 。
(2)将上述溶液加蒸馏水稀释,在稀释过程中,下列各项中增大的是 (填字母编号)。

(3)25℃时,CH3COOH的电离平衡常数为1.75×10-5,现将一定量的CH3COOH与NaOH溶液混合,若测得混合液pH=5.6,则混合液中各离子浓度由大到小的顺序是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)已知25℃时几种物质(溶液浓度为0.1mol/L)的电离度如下表:(电离度:弱电解质已电离的分子的物质的量占分子总物质的量的百分数)(已知:H2SO4的第一步电离是完全的)
| ①H2SO4溶液中的HSO | ②NaHSO4溶液中的HSO | ③CH3COOH | ④HCl |
| 10% | 29% | 1.33% | 100% |
i25℃时,0.1mol/L上述几种溶液c(H+)由大到小的顺序是(填序号) .
ii25℃时,将足量的Zn粉放入等体积、pH=1的上述几种溶液中,产生氢气的体积(同温同压下)由大到小的顺序是(填序号) .
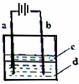 (2)由于Fe(OH)2极易被氧化,所以实验室难以用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。若用下图所示实验装置,可制得纯净的Fe(OH)2沉淀。两极材料分别为石墨和铁。
(2)由于Fe(OH)2极易被氧化,所以实验室难以用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。若用下图所示实验装置,可制得纯净的Fe(OH)2沉淀。两极材料分别为石墨和铁。
i a电极材料为 ,其电极反应式为 ;
电解过程中,b极附近溶液pH= (增大、减小、不变),
试用必要的文字说明原因 。
ii d电解液是 时,电解片刻后,装置中可见Fe(OH)2白色沉淀。
A.稀硫酸 B.NaCl溶液
C.NaOH溶液 D.CuCl2溶液
iii 装置中液体c的作用是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
以焦炭为原料的制氨流程示意如下:
I、“精制”过程是将含有少量CO、CO2、O2和H2S等杂质的原料气体通入含有氨水的醋酸亚铜二氨(化学式为[Cu (NH3)2]Ac)溶液,以获得纯净原料气。其中,吸收CO的反应为:
![]() CO+ [Cu (NH3)2]Ac+NH3·H2O [Cu (NH3)3CO]Ac +H2O
CO+ [Cu (NH3)2]Ac+NH3·H2O [Cu (NH3)3CO]Ac +H2O ![]() <0
<0
(1)为提高CO吸收率,可采取的一项措施是_________________________。
(2)除去氧气时,氧气将 [Cu (NH3)2]Ac氧化为 [Cu (NH3)4]Ac2,则反应中还原剂与氧化剂的物质的量之比是
II、“造气”过程中。其中,焦炭与水蒸气在反应体系中将发生如下四个反应:
![]() C(s)+2H2O(g) CO2(g)+2H2(g)
C(s)+2H2O(g) CO2(g)+2H2(g) ![]() 1=+90.2kJ·mol-1
1=+90.2kJ·mol-1
C(s)+H2O(g) CO(g)+ H2(g) ![]() 2=+131.4kJ·mol-1
2=+131.4kJ·mol-1
 CO(g)+ H2O(g) CO2(g)+ H2(g)
CO(g)+ H2O(g) CO2(g)+ H2(g) ![]() 3
3
C(s)+ 2H2(g) CH4(g) ![]() 4
4
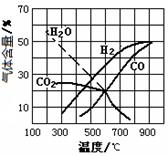
该体系中,一些物质的平衡组成与温度的关系图如右所示。
(3)由图可知,若采用焦炭与水蒸气反应来获得优质的水
煤气,工业生产中应尽量使焦炭和水蒸气在________(填“高
温”、“低温”或“常温”)条件下进行![]()
(4)![]() 3=__________________________。
3=__________________________。
(5)下表为碳与氢气合成甲烷的相关数据:
| 温度(℃) | 600 | 800 | 1000 |
| 平衡常数 | 3.2×100-146 | 1.0×10-2070 | 1.0×10-20000 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com