
| A. | 洗净的滴定管和容量瓶可以放进烘箱中烘干 | |
| B. | 用10mL量筒量取10.00mLNaCl溶液 | |
| C. | 酸式滴定管装标准溶液前,必须先用该溶液润洗2~3次 | |
| D. | 用容量瓶配溶液时,若加水超过刻度线,立即用滴管吸出多余液体 |
科目:高中化学 来源: 题型:选择题
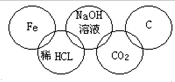 某同学在奥运五连环中填入了5种物质,相连环物质间能发生反应,不相连间不能发生反应.你认为在“五连环”物质的反应中,属于氧化还原反应的有几个,哪种基本反应类型没有涉及到( )
某同学在奥运五连环中填入了5种物质,相连环物质间能发生反应,不相连间不能发生反应.你认为在“五连环”物质的反应中,属于氧化还原反应的有几个,哪种基本反应类型没有涉及到( )| A. | 1个、复分解反应 | B. | 2个、分解反应 | C. | 3个、化合反应 | D. | 2个、置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①④ | D. | 只有④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
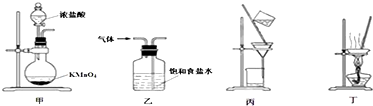
| A. | 用装置甲制取氯气 | |
| B. | 用装置乙除去氯气中的少量氯化氢 | |
| C. | 用装置丙分离二氧化锰和氯化锰溶液 | |
| D. | 用装置丁蒸发浓缩氯化锰溶液,冷却可得MnCl2•4H2O晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
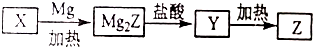
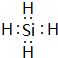 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
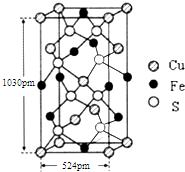 黄血盐(亚铁氰化钾,K4[Fe(CN)6])易溶于水,广泛用作食盐添加剂(抗结剂),食盐中黄血盐的最大使用量为10mg•kg-1.黄血盐经长时间火炒,超过400℃时会分解生成剧毒的氰化钾.回答下列问题:
黄血盐(亚铁氰化钾,K4[Fe(CN)6])易溶于水,广泛用作食盐添加剂(抗结剂),食盐中黄血盐的最大使用量为10mg•kg-1.黄血盐经长时间火炒,超过400℃时会分解生成剧毒的氰化钾.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
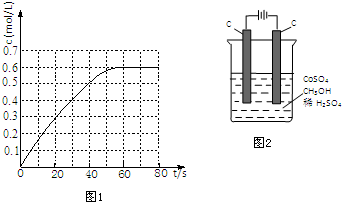
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥ | B. | ④⑥ | C. | ②③④ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M、N全部变成了Q | |
| B. | M、N、Q三种物质的浓度一定相等 | |
| C. | 反应已经停止 | |
| D. | 反应混合物各成分的百分组成不再变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com