
下列实验的现象与对应结论均正确的是
选项 | 操作 | 现象 | 结论 |
A | 将浓硫酸滴到蔗糖表面 | 固体变黑膨胀 | 浓硫酸有脱水性和强氧化性 |
B | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al与浓硝酸不反应 |
C | 二氧化硫通入品红溶液中 | 品红溶液褪色 | 二氧化硫具有还原性 |
D | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水在高温下发生反应 |
 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源:2014-2015湖南省高一上学期期中考试化学试卷(解析版) 题型:选择题
下列各组物质,按化合物、单质、混合物顺序排列的是
A.烧碱、氧气、氢氧化钠溶液 B.生石灰、白磷、熟石灰
C.干冰、铁、氯化氢 D.空气、氮气、胆矾
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省高二上学期第三次月考化学试卷(解析版) 题型:选择题
根据如图,可判断出下列离子方程式中错误的是

A.2Ag(s)+Cd2+(aq) 2Ag+(aq)+Cd(s) B.Co2+(aq)+Cd(s)
2Ag+(aq)+Cd(s) B.Co2+(aq)+Cd(s) Co(s)+Cd2+(aq)
Co(s)+Cd2+(aq)
C.2Ag+(aq)+Cd(s) 2Ag(s)+Cd2+(aq) D.2Ag+(aq)+Co(s)
2Ag(s)+Cd2+(aq) D.2Ag+(aq)+Co(s) 2Ag(s)+Co2+(aq)
2Ag(s)+Co2+(aq)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三上学期第四次月考化学试卷(解析版) 题型:实验题
(16分)某研究所对含硫酸亚铁和硫酸铜的工业废料进行相关的研究。实验过程如下:

回答下列问题:
(1)滤渣的成分为____和____,(填化学式) 操作①的名称为____ 。
(2)上图溶液B中所发生反应的离子方程式为 __________  。
。
(3)实验要求向溶液B中通入过量的空气,证明通入空气过量的方法是 。
(4)操作③第一步需要的仪器除了酒精灯、铁架台外,还需要___ _和___ _ 。
(5)某同学利用下面装置制备氢气并利用氢气还原某金属氧化物,根据要求回答问题。

请设计一个实验方案验证H2的还原性 并检验其氧化产物,其装置连接顺序是A→_____→_____→_____→D(除D装置外,其它装置不能重复使用),最后D装置中所加药品为________ ___,其作用是
并检验其氧化产物,其装置连接顺序是A→_____→_____→_____→D(除D装置外,其它装置不能重复使用),最后D装置中所加药品为________ ___,其作用是 ___________。
___________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三上学期第四次月考化学试卷(解析版) 题型:选择题
下图是模拟电化学反应装置图。下列说法正确的是
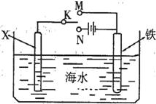
A.若X为碳棒,开关K置于N处,会加快铁的腐蚀
B.若X为锌,开关K置于N处,则X极上有黄绿色气体生成
C.若X为碳棒,开关K置于M处,则铁电极的电极反应式为: Fe-3e- =Fe3+
D.若X为锌,开关K置于M处,则总反应方程式为:2Zn+O2+2H2O=2Zn(OH)2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三上学期第四次月考化学试卷(解析版) 题型:选择题
下列离子方 程式书写正确的是
程式书写正确的是
A.NaHSO4溶液与Ba(OH)2溶液反应至中性: H++SO42-+Ba2++OH- = BaSO4↓+H2O
B.钢铁发生吸氧腐蚀的正极反应式:O 2+ 4e- +2H2O =4OH—
C.足量的溴化亚铁和少量的氯气反应:2Fe2++4Br-+3Cl2=3Fe3++2Br2+6Cl-
D.用铁作电极电解饱和食盐水:2Cl-+2H2O Cl2↑+H
Cl2↑+H 2↑+2OH-
2↑+2OH-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三上学期第四次月考化学试卷(解析版) 题型:选择题
下列关于有机物的认识正确的是
A.油脂、葡萄糖、蛋白质都是人体重要的营养物质,它们都会水解
B.丁烷(C4H10)和二氯甲烷都存在同分异构体
C.只用新制的Cu(OH)2悬浊液可以鉴别乙酸溶液、葡萄糖溶液和淀粉溶液
D.汽油、柴油、植物油都是碳氢化合物
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三上学期10月月考化学试卷(解析版) 题型:填空题
(12分)Ⅰ.近年来,地震、洪水、泥石流等各种自然灾害频发,灾害过后,对环境进行消毒杀菌、获取洁净的饮用水都需要大量消毒剂,开发具有广谱、高效、低毒的杀菌、消毒剂是今后发展的趋势。
(1)Cl2、H2O2、ClO2(还原产物为Cl-)、O3(1 mol O3转化为1 mol O2和1 mol H2O)等物质常被用作消毒剂。等物质的量的上述物质中消毒效率最高的是 (填序号)。
A.Cl2 B.H2O2 C.O3 D.ClO2
(2)过氧乙酸(CH3COOOH)是一种多用途的新型液体消毒杀菌剂, 它具有CH3COOH 和H2O2的双重性质。下列物质与过氧乙酸混合,不会使过氧乙酸失效的是 (填序号)。
A.FeCl3 B.KMnO4溶液 C.稀盐酸 D.NaHCO3溶液
(3)消毒试剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年。亚氯酸不稳定可分解,反应的离子方程式为:HClO2―→ClO2↑+H++Cl-+H2O(未配平)。在该反应中,当有1 mol ClO2生成时,转移的电子数是 。
(4)氯氨(NH2Cl)可作杀菌剂,请用化学方程式表示氯氨在水中的杀菌机理: 。
Ⅱ.近年来发现许多生物体组织中存在的少量NO有扩张血管、免疫、增强记忆的功能,成为当前生命科学的研究热点。请回答下列问题:
(5)NO在大气层中可发生反应:NO+O2= NO2 + O,NO2 + O =NO + O2 ,从反应最终结果看,NO是一种 (填序号);
A.氧化剂
B.还原剂
C.还原产物
D.氧化产物
E.催化剂
(6)将NO转化为无毒气体,可选用NH3在400℃左右并有催化剂存在下把NO还原为氮气和水,写出该反应的化学方程式 ;
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省日照市高三12月校际联合检测化学试卷(解析版) 题型:填空题
(14分)化学反应原理在科研和工农业生产中有广泛应用。
(1)某化学兴趣小组进行工业合成氨的模拟研究,反应的方程式为N2(g)+3H2(g)  2NH3(g) ΔH<0。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间(t)的变化如下图所示:
2NH3(g) ΔH<0。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间(t)的变化如下图所示:
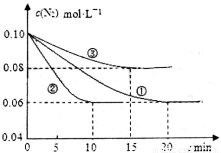
实验②从初始到平衡的过程中,该反应的平均反应速率v(NH3)=__________________;与实验①相比,实验②和实验③所改变的实验条件分别为下列选项中的__________、__________(填字母编号)。
A.增大压强
B.减小压强
C.升高温度
D.降低温度
E.使用催化剂
(2)已知NO2与N2O4可以相互转化:2NO2(g) N2O4(g)。
N2O4(g)。
①T℃时,将0.40 mol NO2气体充入容积为2L的密闭容器中,达到平衡后,测得容器中c(N2O4)=0.05 mol/L,则该反应的平衡常数K=_______________;
②已知N2O4在较高温度下难以稳定存在,易转化为NO2,若升高温度,上述反应的平衡常数K将_____________(填“增大”、“减小”或“不变”)。
③向绝热密闭容器中通入一定量的NO2,某时间段内正反应速率随时问的变化如图所示。下列说法正确的是__________(填字母编号)。
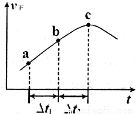
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.Δt1=Δt2时,NO2的转化率:a~b段小于 b~c段
(3)25℃时,将amol/L的氨水与b mol/L盐酸等体积混合,反应后溶液恰好显中性,则a______b。 (填“>”、“<”或“=”);用a、b表示NH3 H2O的电离平衡常数Kb=________________。
H2O的电离平衡常数Kb=________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com