
分析 往AgNO3溶液中逐滴加入氨水,先产生沉淀,后沉淀不断溶解得到溶液,加入葡萄糖溶液水浴加热,有银镜产生,醛和新制氢氧化铜发生氧化还原反应生成羧酸、氧化亚铜和水,据此分析解答.
解答 解:往AgNO3溶液中逐滴加入氨水,银离子和氨水反应生成白色的氢氧化银沉淀和铵根离子,离子反应方程式为:Ag++NH3•H2O═AgOH↓+NH4+;继续滴入氨水白色沉淀溶解,氢氧化银和氨水反应生成银氨溶液和水,离子反应方程式为:AgOH+2NH3•H2O═[Ag(NH3)2]OH+2H2O,边滴边振荡直滴到沉淀恰好溶解为止,再加入乙醛溶液后,生成乙酸铵,氨气、银和水,化学反应方程式为:CH3CHO+2Ag(NH3)2OH$\stackrel{水浴}{→}$CH3COONH4+2Ag↓+3NH3+H2O,在加热条件下,丙二醛和新制氢氧化铜发生氧化还原反应生成丙二酸、氧化亚铜和水,反应方程式为:CHOCH2CHO+4Cu(OH)2$\stackrel{△}{→}$COOHCH2COOH+2Cu2O↓+4H2O,
故答案为:白色沉淀;白色沉淀溶解;CH3CHO+2Ag(NH3)2OH$\stackrel{水浴}{→}$CH3COONH4+2Ag↓+3NH3+H2O;CHOCH2CHO+4Cu(OH)2$\stackrel{△}{→}$COOHCH2COOH+2Cu2O↓+4H2O.
点评 本题考查银镜反应原理以及反应方程式的书写,侧重考查离子反应方程式的书写、醛基的性质,注意银离子和少量氨水、过量氨水反应的产物不同,为易错点,题目难度不大.


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2的用途广泛,主要用途是用于做半导体材料 | |
| B. | SiO2不与任何酸或碱性性氧化物反应 | |
| C. | SiO2和CO2的结构不同,但它们都具有氧化性,都能与强碱反应 | |
| D. | 因为高温时二氧化硅与碳酸钠反应放出CO2,所以硅酸的酸性比碳酸强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在纯水中加入少量硫酸或硫酸铵,均可抑制水的电离 | |
| B. | 电解质越弱,则其溶液的导电能力就越差 | |
| C. | 在白色ZnS沉淀上滴CuSO4溶液,沉淀变黑,说明相同条件下溶解度CuS比ZnS更小 | |
| D. | 加热NaR溶液时,溶液的pH变小,证明HR为弱酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH-═Cl-+ClO-+H2O | |
| B. | 该消毒液与洁厕灵(主要成分为HCl)混用,产生Cl2:2H++Cl-+ClO-═Cl2↑+H2O | |
| C. | 该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ClO-═HClO+CH3COO- | |
| D. | 该消毒液中通入SO2气体可以增强漂白效果 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | M | N | 除杂试剂 | 除杂方法 |
| A | C2H5OH | H2O | 生石灰 | 蒸馏 |
| B | CH4 | CH2═CH2 | 酸性KMnO4溶液 | 洗气 |
| C | CH3COOCH2CH3 | CH3COOH、C2H5OH | NaOH溶液 | 分液 |
| D | 苯酚 | 三溴苯酚 | 水 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
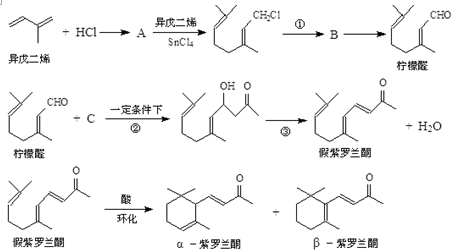
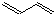 +Cl2$\stackrel{1,4加成}{→}$
+Cl2$\stackrel{1,4加成}{→}$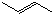
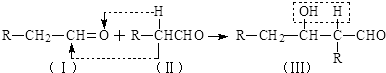
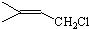 ,C的结构简式
,C的结构简式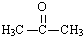 .
.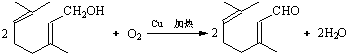 .
.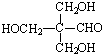 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
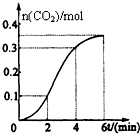 CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示.下列结论不正确的是( )
CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示.下列结论不正确的是( )| A. | 反应2~4分钟内平均反应速率最大 | |
| B. | 反应4分钟后平均反应速率最小 | |
| C. | 反应开始4分钟内温度对反应速率的影响比浓度大 | |
| D. | 反应在第2分钟初至第3分钟末生成CO2的平均反应速率为0.1mol/(L•min) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com