
 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:选择题
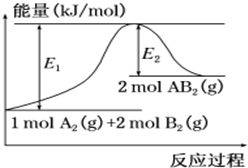 已知某化学反应A2 (g)+2B2 (g)═2AB2(g) (AB2的分子结构为B-A-B)的能量变化如图所示,下列有关叙述中正确的是( )
已知某化学反应A2 (g)+2B2 (g)═2AB2(g) (AB2的分子结构为B-A-B)的能量变化如图所示,下列有关叙述中正确的是( )| A. | 该反应的进行一定需要加热 | |
| B. | 该反应的△H=-(E1-E2)kJ/mol | |
| C. | 该反应中反应物的键能总和大于生成物的键能总和 | |
| D. | 断裂1 mol A-A和2 mol B-B放出E1 kJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O的摩尔质量是18g | B. | 1mol氧的质量是16g | ||
| C. | 氧气的摩尔质量是32g•mol-1 | D. | 2molH2的摩尔质量是4g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
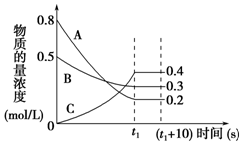
| A. | t1s时反应物A的转化率为60% | |
| B. | 在t1~(t1+10)s时,v(A)=v(B)=0 | |
| C. | 该反应的化学方程式为3A+B?2C | |
| D. | 0~t1s内A的反应速率为v(A)=$\frac{0.2}{{t}_{1}}$mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将饱和FeCl3溶液滴加入冷水中直接就能制得Fe(OH)3胶体 | |
| B. | 胶体区别于其它分散系的本质特征是胶体粒子的直径大小 | |
| C. | 用过滤的方法可以分离和提纯胶体 | |
| D. | 煮鸡蛋的过程中发生了胶体的电泳现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴离子具有氧化性 | B. | 氯气是还原剂 | ||
| C. | 氯气发生氧化反应 | D. | 氧化性:Cl2>Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
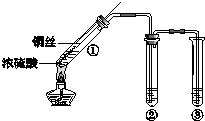 某小组同学探究浓硫酸及其部分反应产物的化学性质,装置如图所示(夹持装置略去).
某小组同学探究浓硫酸及其部分反应产物的化学性质,装置如图所示(夹持装置略去).查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com