【题目】(1)氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:6NO(g) + 4NH3(g)  5N2(g) +6H2O(g)。
5N2(g) +6H2O(g)。
①能说明该反应已达到平衡状态的标志是_______
a.反应速率 ( NH3) =
( NH3) = ( N2)
( N2)
b.容器内压强不再随时间而发生变化
c.容器内N2的物质的量分数不再随时间而发生变化
d.容器内n(NO)∶n(NH3)∶n(N2)∶n(H2O) = 6∶4∶5∶6
②某次实验中测得容器内NO及N2的物质的量随时间变化如图所示,图中b点对应的速率关系是 (正)____
(正)____ (逆)(填“﹥”、“﹤”或“﹦”),d点对应的速率关系是
(逆)(填“﹥”、“﹤”或“﹦”),d点对应的速率关系是 (正)____
(正)____ (逆)(填﹥、﹤或﹦)。
(逆)(填﹥、﹤或﹦)。

(2)298 K时,若已知生成标准状况下2.24 L NH3时放出热量为4.62 kJ。写出合成氨反应的热化学方程式_______。在该温度下,取1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量总小于92.4 kJ,其原因是________。
(3)一定条件下,在2 L密闭容器内,反应2NO2(g) N2O4(g) ΔH=-180 kJ·mol-1,n(NO2)随时间变化如下表:
N2O4(g) ΔH=-180 kJ·mol-1,n(NO2)随时间变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 0.040 | 0.020 | 0.010 | 0.005 | 0.005 | 0.005 |
用NO2表示0~2 s内该反应的平均速度__________。在第5 s时,NO2的转化率为_________。根据上表可以看出,随着反应进行,反应速率逐渐减小,其原因是______。
【答案】 bc ﹥ = N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1 合成氨是一个可逆反应,1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,N2和H2不能全部转化为NH3 0.0075 mol·L-1·s-1 87.5% 随着反应的进行,二氧化氮的物质的量浓度减小
2NH3(g) ΔH=-92.4 kJ·mol-1 合成氨是一个可逆反应,1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,N2和H2不能全部转化为NH3 0.0075 mol·L-1·s-1 87.5% 随着反应的进行,二氧化氮的物质的量浓度减小
【解析】(1)①化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量也不变;②根据化学平衡的建立过程和平衡特征分析解答;
(2)根据题意计算出生成2mol氨气放出的热量,写出该反应的热化学方程式;合成氨的反应为可逆反应,反应物不可能完全转化成生成物;
(3)结合v=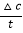 计算反应速率,转化率为
计算反应速率,转化率为 ×100%,浓度减小导致反应速率减小。
×100%,浓度减小导致反应速率减小。
(1)①a.该反应达到平衡状态时,5v(NH3)正=4v(N2)逆,故a错误;b.该反应是一个反应前后气体体积增大的可逆反应,当反应达到平衡状态时,容器内压强不随时间的变化而变化,所以能判断反应是否达到平衡状态,故b正确;c.容器内N2的物质的量分数不再随时间而发生变化说明浓度不再改变,故c正确;d.物质的量之比不能说明正逆反应速率相等或者浓度不变,故d错误;故答案为:bc;
②根据图像,b点是建立平衡过程中的一点,因此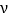 (正)>
(正)>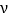 (逆),d点为平衡状态,
(逆),d点为平衡状态,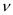 (正)=
(正)=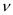 (逆),故答案为:>;=;
(逆),故答案为:>;=;
(2)N2(g)+3H2(g)2NH3(g)反应中生成标准状况下2.24 L (0.1mol)NH3时放出热量为4.62 kJ,则生成2mol氨气放出92.4kJ热量,反应的热化学方程式为N2(g)+3H2(g)2NH3(g) △H=-92.4kJ/mol,合成氨是一个可逆反应,1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,N2和H2不能全部转化为NH3,因此l molN2和3molH2放在密闭容器中,在催化剂存在下进行反应,放出的热量总小于92.4kJ,故答案为:N2(g)+3H2(g)2NH3(g) △H=-92.4kJ/mol;合成氨是一个可逆反应,1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,N2和H2不能全部转化为NH3;
(3)用NO2表示0~2s内该反应的平均速度为 =0.0075molL-1s-1,在第5s时,NO2的转化率为
=0.0075molL-1s-1,在第5s时,NO2的转化率为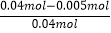 ×100%=87.5%,根据上表可以看出,随着反应进行,反应速率逐渐减小,其原因是随着反应的进行,二氧化氮的物质的量浓度减小,故答案为:0.0075molL-1s-1;87.5%;随着反应的进行,二氧化氮的物质的量浓度减小。
×100%=87.5%,根据上表可以看出,随着反应进行,反应速率逐渐减小,其原因是随着反应的进行,二氧化氮的物质的量浓度减小,故答案为:0.0075molL-1s-1;87.5%;随着反应的进行,二氧化氮的物质的量浓度减小。
练习册系列答案
相关习题
科目:高中化学
来源:
题型:
【题目】下列说法不正确的是( )
A.乙烯为不饱和烃,分子中6个原子处于同一平面
B.乙炔与溴的四氯化碳溶液发生加成反应而使其褪色
C.乙烯与溴水发生加成反应的产物是CH2CH2Br2
D.等物质的量的甲烷与氯气反应的产物有5种
查看答案和解析>>
科目:高中化学
来源:
题型:
【题目】大雾天气可致使高速公路关闭、航班停飞。雾能产生丁达尔效应,雾属于分散系中的
A.胶体 B.悬浊液 C.溶液 D.乳浊溶液
查看答案和解析>>
科目:高中化学
来源:
题型:
【题目】控制适合的条件,将反应Fe3++AgFe2++Ag+设计成如右图所示的原电池,(盐桥装有琼脂﹣硝酸钾溶液;灵敏电流计的0刻度居中,左右均有刻度)已知,接通后,观察到电流计指针向右偏转.下列判断正确的是( ) 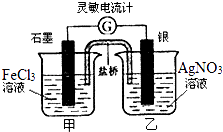
A.在外电路中,电子从石墨电极流向银电极
B.盐桥中的K+移向乙烧杯
C.一段时间后,电流计指针反向偏转,越过0刻度,向左边偏转
D.电流计指针居中后,往甲烧杯中加入一定量的铁粉,电流计指针将向左偏转
查看答案和解析>>
科目:高中化学
来源:
题型:
【题目】下面所写的有机反应方程式及其类型都正确的是
A.  取代反应
取代反应
B. 2CH3CHO+ O2 → 2CH3COOH 氧化反应
C. CH2=CH2 + Br2 → CH3CHBr2 加成反应
D. HCOOH + CH3CH2OH  HCOOCH3CH2+ H2O 取代反应
HCOOCH3CH2+ H2O 取代反应
查看答案和解析>>
科目:高中化学
来源:
题型:
【题目】某课外活动小组用下图装置进行实验,试回答:
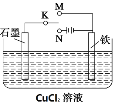
(1)若开始时K接M,则该装置为________(填“原电池”或“电解池”)铁极上的电极反应式为________。
(2)若开始时K接N,则石墨极为______极(填“正”、“负”、“阳” 或“阴”),装置中的总化学方程式为________,铁极上的现象为________,石墨电极的反应现象为________,若反应过程中有0.1mol的电子发生转移,则铁电极上产生物质的质量为____g,石墨极上产生的物质在标准状况下的体积为________L。
查看答案和解析>>
科目:高中化学
来源:
题型:
【题目】钙能调节人体各系统生理功能,利用如图装置测定碳酸钙型补钙剂中钙的含量。已知氨基磺酸(H2NSO3H)俗称固体硫酸,在水溶液中为一元酸,广泛应用于锅炉水垢的清洗。
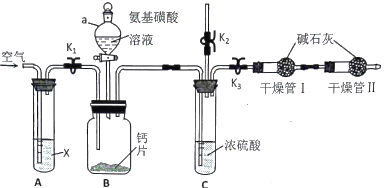
(1)A装置的作用为___________________,仪器a的名称为____________________。
(2)B 装置内发生反应的化学方程式为___________________________________,实验中不用盐酸与钙片反应的原因是_______________________________________。
(3)组装好仪器后,检查装置的气密性,接下来进行的操作是:打开K1、K2,关闭K3,通空气一段时间, ________________(填操作),打开仪器a活塞,滴入氨基磺酸溶液,待B装置中无气泡产生,关闭仪器a活塞。再次打开K1通空气一段时间,第二次通入空气目的是_______________________。如果不使用干燥管Ⅱ,测定结果____________(填“偏高”“偏低”“不变”)。
(4)取某补钙剂样品m克进行测定,测得干燥管Ⅰ在实验前后重量分别为m1克和m2克,则样品中钙的质量分数为__________________。
查看答案和解析>>
科目:高中化学
来源:
题型:
【题目】氯酸钾是常见的氧化剂,用于制造火药、烟火,工业上用石灰乳氯化法制备氯酸钾的流程如下
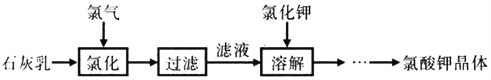
己知:氯化过程主要发生反应6Ca(OH)2+ 6Cl2 5CaCl2+Ca(ClO3)2+6H2O
5CaCl2+Ca(ClO3)2+6H2O
下列说法不正确的是
A. 工业生产氯气的方法是电解饱和食盐水
B. 由制备流程可知:KClO3的溶解度大于Ca(ClO3)2的溶解度
C. 向热的滤液中加入稍过量的氯化钾,溶解后进行冷却,有大量氯酸钾晶体析出
D. 氯化过程需要控制较高温度,其目的是加快反应速率和减少Cl2与Ca(OH)2之间的副反应
查看答案和解析>>
科目:高中化学
来源:
题型:
【题目】学校实验室新购买了高锰酸钾试剂,按分类应将它放在( )
A.甲柜
B.乙柜
C.丙柜
D.丁柜
查看答案和解析>>

![]() 5N2(g) +6H2O(g)。
5N2(g) +6H2O(g)。![]() ( NH3) =
( NH3) =![]() ( N2)
( N2) ![]() (正)____
(正)____![]() (逆)(填“﹥”、“﹤”或“﹦”),d点对应的速率关系是
(逆)(填“﹥”、“﹤”或“﹦”),d点对应的速率关系是![]() (正)____
(正)____![]() (逆)(填﹥、﹤或﹦)。
(逆)(填﹥、﹤或﹦)。
![]() N2O4(g) ΔH=-180 kJ·mol-1,n(NO2)随时间变化如下表:
N2O4(g) ΔH=-180 kJ·mol-1,n(NO2)随时间变化如下表: