
| 实验编号 | 反应物(室温) | 催化剂 |
| a | 10mL5%H2O2溶液+1mLH2O | 0.1gMnO2粉末 |
| b | 10mL5%H2O2溶液+1mL稀HCl | 0.1gMnO2粉末 |
| c | 10mL5%H2O2溶液+1mL稀NaOH溶液 | 0.1gMnO2粉末 |

| 1000ρω |
| M |
| ||
| ||
| 1000ρω |
| M |
| 1000×1g/L×5% |
| 34g/mol |
| 2.5×0.1000×0.018 |
| 0.02 |


科目:高中化学 来源: 题型:
 根据要求完成下列各小题实验目的.(a、b 为弹簧夹,加热及固定装置已略去)
根据要求完成下列各小题实验目的.(a、b 为弹簧夹,加热及固定装置已略去)| 滴加的溶液 | 氯 水 | 氨 水 |
| 沉淀的化学式 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在任何条件下,纯水都呈中性 |
| B、pH<7的溶液一定呈酸性 |
| C、25℃时,纯水和稀酸溶液中水的离子积常数不相符 |
| D、pH均等于6的NH4Cl溶液和CH2COOH溶液中,水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知A、B、C是常见的单质,在一定条件下相互转化的关系如图所示(有部分物质省略)
已知A、B、C是常见的单质,在一定条件下相互转化的关系如图所示(有部分物质省略)查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向无色溶液加入盐酸酸化的氯化钡溶液有白色沉淀,结论:溶液中含有SO42- |
| B、无色溶液焰色反应呈黄色,结论:溶液中含有Na+ |
| C、向无色试液加入硝酸酸化的硝酸银溶液产生白色沉淀,结论:溶液中含Cl-- |
| D、向某溶液中加入氢氧化钠溶液加热,有能使湿润的红色石蕊试纸变蓝的气体生成,结论:溶液中含有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3CH2OCH3 |
| B、CH3COOH |
| C、CH3CH2CH2OH |
| D、CH3CH2CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:
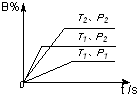 已知某可逆反应m A(g)+n B(气)?p C(气)+Q,在密闭容器中进行,右图表示在不同反应时间t 时温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线.由曲线分析,下列判断正确的是( )
已知某可逆反应m A(g)+n B(气)?p C(气)+Q,在密闭容器中进行,右图表示在不同反应时间t 时温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线.由曲线分析,下列判断正确的是( )| A、T1<T2,P1>P2,m+n>p,Q>0 |
| B、T1>T2,P1<P2,m+n>p,Q<0 |
| C、T1<T2,P1>P2,m+n<p,Q>0 |
| D、T1>T2,P1<P2,m+n<p,Q>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+一定存在 |
| B、100 mL溶液中含0.02 mol CO32- |
| C、Cl-一定存在 |
| D、Ba2+一定不存在,Mg2+可能存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学键 | C-H | C-F | H-F | F-F |
| 键能 | 414 | 489 | 565 | 158 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com