
分析 (1)向溶液中滴入KSCN溶液,未见颜色变化,说明硫酸过量,反应后溶液中铁元素完全转化成亚铁离子,据此写出反应的化学方程式;根据反应方程式计算出混合物中单质铁的质量;
(2)将Fe2完全转化为Fe(OH)2,此时溶质为硫酸钠,根据质量守恒计算出原硫酸的物质的量浓度.
解答 解:(1)由题意可知,反应后的溶液中Fe元素的存在形式为Fe2+,
故发生反应有:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O、Fe+Fe2(SO4)3=3FeSO4、Fe+H2SO4=FeSO4+H2↑,
生成氢气的物质的量为:n(H2)=$\frac{1.68L}{22.4L/mol}$=0.075mol,
与H2SO4反应的铁的物质的量为:n(Fe)=n(H2)=0.075mol,
综合前两个反应方程式可知:与Fe2(SO4)3反应的铁为 n(Fe)ˊ=n[Fe2(SO4)3]=n(Fe2O3),
铁与氧化铁的总质量为15g,则:(n(Fe)ˊ+0.075mol)×56g/mol+n(Fe)ˊ×160g/mol=15g,
解得:n(Fe)ˊ=0.05mol,
混合物中铁的物质的量为:n(Fe)=0.075mol+0.05mol=0.125mol,
所以混合物中铁的质量为:m(Fe)=0.125mol×56g/mol=7g,
故答案为:7;
(2)中和过量的H2SO4,且使Fe2+完全转化成Fe(OH)2,反应后的溶液中溶质为Na2SO4,
则:n(H2SO4)=n(Na2SO4)=$\frac{1}{2}$n(NaOH)=$\frac{1}{2}$×3mol/L×0.2L=0.3mol,
原硫酸的浓度为:c(H2SO4)=$\frac{0.3mol}{0.15L}$=2mol/L,
故答案为:2mol/L.
点评 本题考查了混合物反应的计算,题目难度中等,根据题干信息正确判断发生反应为解答关键,注意质量守恒在化学计算中的应用,试题侧重考查学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
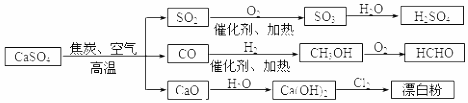
| A. | CO、SO2均为无色有刺激性气味的有毒气体 | |
| B. | 工业上利用Cl2 和澄清石灰水反应来制取漂白粉 | |
| C. | 除去与水反应,图示转化反应均为氧化还原反应 | |
| D. | 用CO合成CH3OH进而合成HCHO的两步反应,原子利用率均为100% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 化学键 | H-H | N-H | N≡N |
| 键能(kJ•mol-1) | 436 | 391 | 945 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上10月月考化学试卷(解析版) 题型:选择题
物质的量浓度相同的三种盐NaX、NaY和NaZ的溶液其PH依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是( )
A.HX、HZ、HY B.HZ、HY、HX C.HX、HY、HZ D.HY、HZ、HX
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com