
铜锌原电池(如下图)工作时,下列叙述正确的是( )

A.正极反应为:Zn-2e-===Zn2+
B.电池反应为:Zn+Cu2+===Zn2++Cu
C.在外电路中,电子从负极流向正极
D.盐桥中的K+移向ZnSO4溶液
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
前四周期主族非金属元素X、Y、Z和W在元素周期表中的相应位置如图所示。下列说法正确的是( )
| X | Y | |
| Z | W |
A.元素X和元素W最高正价代数和一定为8
B.若元素X的原子序数为a,则Z的原子序数一定为a+9
C.常温下,若X的简单氢化物的水溶液能使红色石蕊试液变蓝,则元素Y的简单氢化物的沸点一定高于元素W的简单氢化物
D.原子半径的大小顺序为rW>rZ>rX>rY
查看答案和解析>>
科目:高中化学 来源: 题型:
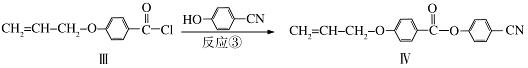
液晶高分子材料应用广泛,新型液晶基元﹣﹣化合物IV的合成线路如下:
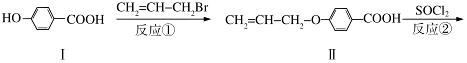
(1)化合物Ⅰ的分子式为 ,1mol化合物Ⅰ最多可与 mol NaOH反应。
(2)CH2=CH﹣CH2Br与NaOH水溶液反应的化学方程式为 (注明条件)。
(3)化合物I的同分异构体中,苯环上一溴代物只有2种且能发生银镜反应的化合物有多种,写出其中一种同分异构体的结构简式 (任写一种)。
(4)反应③的反应类型是 .在一定条件下,化合物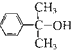 也可与III发生类似反应③的反应生成有机物V,V的结构简式是 。
也可与III发生类似反应③的反应生成有机物V,V的结构简式是 。
(5)下列关于化合物Ⅳ的说法正确的是 (填字母)。
A.属于烯烃 B.能与FeCl3溶液反应显紫色
C.一定条件下能发生加聚反应 D.能使溴的四氯化碳溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
镍氢电池(NiMH)目前已经成为混合动力汽车的一种主要电池类型,NiMH中的M表示储氢金属或合金,该电池在充电过程中的总反应方程式是Ni(OH)2+M===NiOOH+MH。
已知:6NiOOH+NH3+H2O+OH-===6Ni(OH)2+NO
下列说法正确的是( )
A.NiMH电池放电过程中,正极的电极反应式为NiOOH+H2O+e-===Ni(OH)2+OH-
B.充电过程中OH-从阳极向阴极迁移
C.充电过程中阴极的电极反应式:H2O+M+e-===MH+OH-,H2O中的H被M还原
D.NiMH电池中可以用KOH溶液、氨水等作为电解质溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
用FeCl3酸性溶液脱除H2S后的废液,通过控制电压电解得以再生。某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1 mol/L FeCl2溶液,研究废液再生机理。记录如下(a、b、c代表电压值):
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅰ | x≥a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| Ⅱ | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+、无Cl2 |
| Ⅲ | b>x>0 | 无明显变化 | 无Fe3+、无Cl2 |
(1)用KSCN溶液检验出Fe3+的现象是________。
(2)Ⅰ中,Fe3+产生的原因还可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化。写出有关反应的离子方程式:________________________________________________。
(3)由Ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电。原因是Fe2+具有________性。
(4) Ⅱ中虽未检验出Cl2,但Cl-在阳极是否放电仍需进一步验证。电解pH=1的NaCl溶液做对照实验,记录如下:
Ⅱ中虽未检验出Cl2,但Cl-在阳极是否放电仍需进一步验证。电解pH=1的NaCl溶液做对照实验,记录如下:
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅳ | a>x≥c | 无明显变化 | 有Cl2 |
| Ⅴ | c>x≥b | 无明显变化 | 无Cl2 |
①NaCl溶液的浓度是________mol/L。
②Ⅳ中检验Cl2的实验方法:_____________________________________________________。
③与Ⅱ对比,得出的结论(写出两点):_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图为相互串联的甲、乙两个电解池,X、Y为直流电源的两个电极。电解过程中,发现石墨电极附近先变红。请回答:
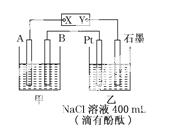
(1)电源X极为______极(填“正”或“负”),乙池中Pt电极上的电极反应式为______。
(2)甲池若为电解精炼铜的装置,其阴极增重12.8 g,则乙池中阴极上放出的气体在标准状况下的体积为______,电路中通过的电子为______mol。
(3)若乙池剩余溶液的体积仍为400 mL,则电解后所得溶液c(OH-)=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。
2NH3(g) ΔH=-92.4 kJ·mol-1。
实验测得起始、平衡时的有关数据如下表:
| 容器 编号 | 起始时各物质物质的量/mol | 平衡时反应中 的能量变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量akJ |
| ② | 2 | 3 | 0 | 放出热量bkJ |
| ③ | 2 | 6 | 0 | 放出热量ckJ |
下列叙述正确的是( )
A.放出热量关系:a<b<92.4
B.三个容器内反应的平衡常数:③>①>②
C.达平衡时氨气的体积分数:①>③
D.N2的转化率:②>①>③
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应属于吸热反应的是
A.CaO+H2O = Ca(OH)2
B.2Na+O2  Na2O2
Na2O2
C.Fe2O3 + 2Al  2Fe + Al2O3
2Fe + Al2O3
D.右图所示的反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中错误的是
A.根据对角线规则,铍和铝的性质具有相似性
B.[Cu(H2O)4]2+中Cu提供空轨道,H2O中O提供孤对电子形成配位键
C.元素电负性越大的原子,吸引电子的能力越强
D.手性分子互为镜像,它们的性质没有区别
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com