
| A. | H2燃烧生成1 mol H2O(g)时,放出241.8 kJ的热量 | |
| B. | 1 mol液态水变成水蒸气时吸收44 kJ的热量 | |
| C. | 1mol物质完全燃烧生成稳定氧化物时放出的热量为燃烧热,H2的燃烧热为-285.8 kJ•mol-1 | |
| D. | O2前面的表示参加反应的O2的分子数目 |
分析 A.由H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-241.8kJ•mol-1的意义分析;
B.设①H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-241.8kJ•mol-1,
②H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H2=-285.8kJ•mol-1,
由盖斯定律可知①-②可得H2O(l)═H2O(g)的△H;
C.氢气的燃烧热为285.8 kJ•mol-1;
D.热化学方程式中的化学计量数只代表物质的量.
解答 解:A.由H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-241.8kJ•mol-1可知,1mol氢气燃烧生成1 mol H2O(g)时,放出241.8 kJ的热量,故A正确;
B.设①H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-241.8kJ•mol-1,
②H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H2=-285.8kJ•mol-1,
由盖斯定律可知①-②可得H2O(l)═H2O(g)△H=-241.8kJ•mol-1+285.8kJ•mol-1=+44kJ•mol-1,所以1 mol液态水变成水蒸气时吸收44 kJ的热量,故B正确;
C.氢气的燃烧热为285.8 kJ•mol-1,不带负号,故C错误;
D.热化学方程式中的化学计量数只代表物质的量,不能代表分子个数,故D错误;
故选CD.
点评 本题考查了热化学方程式的意义、盖斯定律的应用、燃烧热的表示方法,难度不大,注意热化学方程式中的化学计量数只代表物质的量,不能代表分子个数.


科目:高中化学 来源: 题型:选择题
| A. | ①②③④② | B. | ②④②③① | C. | ④②③①② | D. | ②④①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯铁是银白色固体 | |
| B. | 钨有很高的熔点 | |
| C. | 铜容易传热、导电 | |
| D. | 铝在空气中易与氧气反应生成致密的氧化膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 应称取NaOH的质量/g | 应选用容量瓶的规格/mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤ | B. | ②④ | C. | ②⑤ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
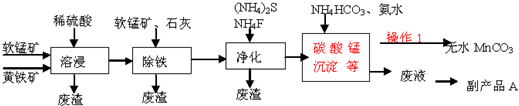
| Fe2+ | Fe3+ | Mn2+ | |
| 开始沉淀的pH | 7.5 | 3.2 | 8.8 |
| 完全沉淀的pH | 9.7 | 3.7 | 10.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 干冰、液态氯化氢都是电解质 | |
| B. | 用可见光束照射以区别溶液和胶体 | |
| C. | Na2O、Fe2O3、Al2O3都是碱性氧化物 | |
| D. | 根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com