
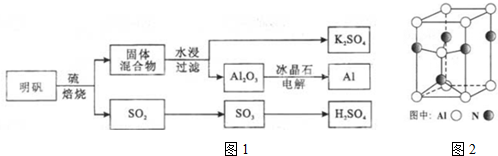
分析 (1)依据化学方程式中元素化合价变化分析判断,元素化合价升高的做还原剂发生氧化反应;
(2)在金属晶体的最密堆积中,对于每个原子来说,在其周围的原子有与之同一层上有六个原子和上一层的三个及下一层的三个,故每个原子周围都有12个原子与之相连;
(3)配位化合物中直接和中心原子(或离子)相联系的配位原子的数目;
(4)氨水和二氧化硫、氯化钡溶液之间会发生反应得到亚硫酸钡沉淀;
(5)利用盖斯定律,将热化学方程式进行运算,(③-①+②)×$\frac{1}{2}$计算反应的焓变,得到SO3 (g)与H2O(l)反应的热化学方程式.
解答 解;(1)4KAl(SO4)2•12H2O+3S═2K2SO4+2Al2O3+9SO2+48H2O反应硫单质中硫元素化合价升高为+4价,硫酸根离子中硫元素化合价从+6价变化为+4价,还原剂是硫单质,
故答案为:S;
(2)在金属晶体的最密堆积中,对于每个原子来说,在其周围的原子有与之同一层上有六个原子和上一层的三个及下一层的三个,故每个原子周围都有12个原子与之相连,对于铜原子也是如此,属于面心立方最密堆积,铜与浓硫酸反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;加热\;}}{\;}$CuSO4+2SO2↑+2H2O.
故答案为:面心立方最密堆积;Cu+2H2SO4(浓)$\frac{\underline{\;加热\;}}{\;}$CuSO4+2SO2↑+2H2O;
(3)依据晶体晶胞结构分析,结合配位数含义可知,每个铝原子和四个单原子相连,所以铝原子的配位数为4,
故答案为:4;
(4)氨水和二氧化硫、氯化钡溶液之间会发生反应得到亚硫酸钡沉淀,发生反应为:2NH3+SO2+H2O+Ba2+=BaSO3↓+2NH4+或2NH3•H2O+SO2+Ba2+=BaSO3↓+2 H2O+2NH4+,故答案为:2NH3+SO2+H2O+Ba2+=BaSO3↓+2NH4+或2NH3•H2O+SO2+Ba2+=BaSO3↓+2 H2O+2NH4+;
(5)2SO2(g)+O2(g)=2SO3(g)△H1=一197kJ/mol ①
2H2O (g)=2H2O(1)△H2=-44kJ/mol ②
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=一545kJ/mol③
利用盖斯定律:(③-①+②)×$\frac{1}{2}$得SO3 (g)+H2O(l)=H2SO4(l)△H=-130kJ/mol,
故答案为:SO3(g)+H2O(l)=H2SO4(l)△H=-130kJ/mol.
点评 本题考查了氧化还原反应概念分析判断,晶体结构的理解分析,原电池反应的实质应用,热化学方程式和盖斯定律的计算,元素守恒的计算应用,题目难度中等.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:选择题
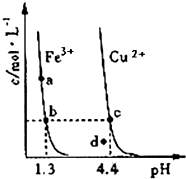 某温度下,将Fe(OH)3(s)、Cu(OH)2(s)分别置于蒸馏水中达到沉淀溶解平衡后,金属阳离子浓度随溶液pH的变化如图所示.下列判断正确的是( )
某温度下,将Fe(OH)3(s)、Cu(OH)2(s)分别置于蒸馏水中达到沉淀溶解平衡后,金属阳离子浓度随溶液pH的变化如图所示.下列判断正确的是( )| A. | 该温度下,Ksp[Fe(OH)3]>Ksp[Cu(OH)2] | |
| B. | c、d 两点代表的溶液中c(H+) 与c(OH-) 乘积不相等 | |
| C. | Cu(OH)2在c点比在d点代表的溶液中溶解程度小 | |
| D. | 加适量浓NH3•H2O可使溶液由a点变到b点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
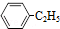 (g)?
(g)?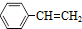 (g)+H2(g)△H=akJ•mol-1,经一段时间后达到平衡,反应过程中测定的部分数据见表:
(g)+H2(g)△H=akJ•mol-1,经一段时间后达到平衡,反应过程中测定的部分数据见表:| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(乙苯)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
| n(苯乙烯)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
| A. | 反应在前20min的平均速率为v(H2)=0.008mol•L-1•min-1 | |
| B. | 保持其他条件不变,升高温度,平衡时,c(乙苯)=0.08 mol•L-1,则a<0 | |
| C. | 保持其他条件不变,平衡后向容器中再充入0.40mol乙苯,再次达到平衡时乙苯的转化率小于50.0% | |
| D. | 相同温度下,起始时向容器中充入0.10 mol乙苯、0.10 mol苯乙烯和0.30 molH2,达到平衡前v(正)>v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 反应时间/min | n(CO)/mol | H2O/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | C-C | C-H | H-H | C-O | C≡O | O-H |
| 键能/kJ/mol | 348 | 413 | 436 | 358 | x | 463 |
| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol/L | 0.5 | 2 | 2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com