
【题目】下列指定反应的离子方程式正确的是
A.钠与水反应:Na+H2O==Na++OH-+H2↑
B.向AlCl3溶液中加入过量氨水:Al3++4NH3·H2O=![]() +4
+4![]() +2H2O
+2H2O
C.FeCl3溶液净水原理:Fe3++3H2O=Fe(OH)3↓+3H+
D.用饱和Na2CO3溶液处理重晶石:BaSO4+![]() -==BaCO3+
-==BaCO3+![]()
【答案】D
【解析】
A.钠与水反应生成氢氧化钠和氢气,反应的离子方程式为2Na+2H2O=2Na++2OH-+H2↑,故A错误;
B.氢氧化铝是两性氢氧化物,溶于强酸、强碱,不溶于弱酸、弱碱,则向AlCl3溶液中与过量氨水反应生成氢氧化铝白色胶状沉淀和氯化铵,反应的离子方程式为Al3++3NH3·H2O=Al(OH)3↓+3NH4+,故B错误;
C.FeCl3在溶液中水解生成氢氧化铁胶体,氢氧化铁胶体具有很大的表面积,能够吸附水中悬浮杂质,达到净水的目的,水解的离子方程式为Fe3++3H2O![]() Fe(OH)3+3H+,故错误;
Fe(OH)3+3H+,故错误;
D.饱和Na2CO3溶液与硫酸钡反应生成碳酸钡和硫酸钠,沉淀转化的离子方程式为BaSO4+CO32--=BaCO3+SO42-,故D正确;
故选D。


科目:高中化学 来源: 题型:
【题目】二氯化砜(SO2Cl2)是一种重要的有机合成试剂,实验室可利用SO2与Cl2反应制取少量的SO2Cl2。装置如图(有些支持装置省略了)所示。已知SO2Cl2的熔点为-54.1℃,沸点为69. 1℃;常温下比较稳定,受热易分解,遇水能发生剧烈的水解反应,产物之一为氯化氢气体。
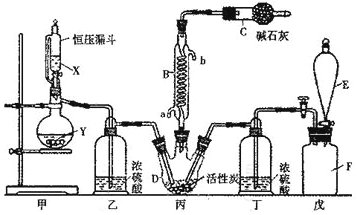
(1)仪器E的名称是_______,由B的使用可知SO2与氯气之间的反应居于______(填“放”或“吸”)热反应,B处反应管冷却水应从___________(填“a”或“b”)接口通入。如果将丙装置放入冰水中,会更有利于二氯化砜的生成,其原因是__________。
(2)试剂X、Y的组合最好是_________。
a.98%硫酸和铜 b.稀硝酸和亚硫酸钠固体 c.60%硫酸和亚硫酸钾固体
(3)戊是贮气装置,则E中的试剂是_________;若缺少装置乙和丁,潮湿的氯气和二氧化硫之间发生反应的化学方程式是___________________________.
(4)取1.00g蒸馏后的液体,小心地完全溶于水,向所得的溶液中加入足量氯化钡溶液,测得生成沉淀的质量为1.50g,则所得馏分中二氯化砜的质量百分含量为__________%(结果保留小数点后1位)。
(5)二氯化砜应储存于阴凉、干燥、通风良好的库房,但久置后微显黄色,其原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
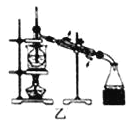
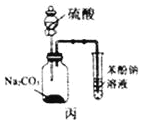
【题目】下列有关实验存在不合理的装置是
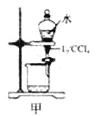

A.装置甲:用CCl4萃取碘水中的碘
B.装置乙:加热碘的CCl4溶液,分离碘并回收CCl4
C.装置丙:验证硫酸、碳酸、苯酚溶液的酸性
D.用乙酸、乙醇制取乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应2SO2+O2![]() 2SO3,反应达平衡的标志是
2SO3,反应达平衡的标志是
①单位时间内消耗2 mol SO2的同时生成2 mol SO3
②反应混合物中,SO2、O2与SO3的物质的量之比为2∶1∶2
③反应混合物中,SO3的质量分数不再改变
A. ①②B. ①③C. ①D. ③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有等体积的硫酸、盐酸和醋酸三种溶液,将它们分别与V1L、V2L、V3L等浓度的NaOH溶液混合,下列说法中正确的是( )
A.若混合前三溶液物质的量浓度相等,混合后溶液呈中性,则V1<V2<V3
B.若混合前三溶液pH相等,酸碱恰好完全反应,则V1=V2>V3
C.若混合前三溶液物质的量浓度相等,酸碱恰好完全反应,则V1>V2>V3
D.若混合前三溶液pH相等,将它们同等倍数稀释后再与足量锌片反应,则醋酸溶液放出气体最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示或根据图示所得出的结论正确的是
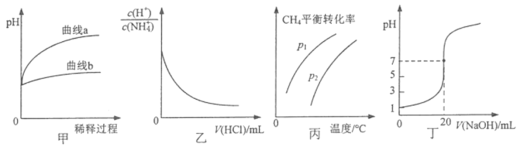
A.图甲表示相同pH的盐酸和醋酸加水稀释过程中pH的变化,则曲线a代表醋酸
B.图乙表示温度不变,向0.1mol·L-1NH4Cl溶液中滴加0.1mol·L-1盐酸时,溶液中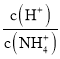 随盐酸体积的变化关系
随盐酸体积的变化关系
C.图丙表示密闭容器中CH4(g)+ H2O(g)CO(g)+3H2(g)到达平衡时,CH4的平衡转化率与压强、温度的变化关系曲线,说明P1<P2
D.图丁表示0.1000mol·L-1NaOH溶液滴定20.00 mL 0.1000mol·L-1醋酸溶液滴定曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜制印刷电路板蚀刻液的选择及再生回收是研究热点。
(1)用HCl-FeCl3溶液作蚀刻液
①该溶液蚀刻铜板时发生主要反应的离子方程式为__________.
②从废液中可回收铜井使蚀刻液再生。再生所用的试剂有Fe和______(填化学式)。
(2)用HCl-CuCl2溶液作蚀刻液蚀刻铜后的废液中含Cu+ 用下图所示方法可使蚀刻液再生并回收金属铜。
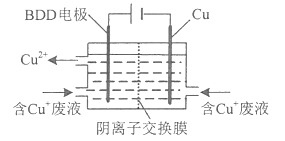
第一步BDD电极上生成强氧化性的氢氧自由基(HO·):H2O-e-==HO·+H+: .
第二步HO·氧化Cu+实现CuCl蚀刻液再生:________(填离子方程式) .
(3)用碱性CuCl2溶液(用NH3·H2O-NH4Cl调节pH)作蚀刻液
原理为:CuCl2+ 4NH3·H2O==Cu(NH3)4Cl2+ 4H2O;Cu(NH3)4Cl2+Cu== 2Cu(NH3)2Cl
①过程中只须及时补充NH3·H2O和NH4Cl就可以使蚀刻液再生,保持蚀刻能力。蚀刻液再生过程中作氧化剂的是_________(填化学式) 。
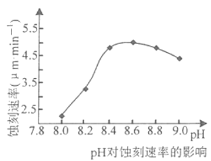
②50℃,c(CuCl2)=2.5mol·L-1, pH对蚀刻速串的影响如图所示。适宜pH约为8.3~9.0,pH过小或过大,蚀刻速率均会减小的原因是______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学院上海有机化学研究所有机氟化学重点实验室在寻找新的![]() 反应砌块的过程中,意外发现一种安全、高效合成罕见的硫(Ⅵ)氟类无机化合物
反应砌块的过程中,意外发现一种安全、高效合成罕见的硫(Ⅵ)氟类无机化合物![]() (氟磺酰基叠氮)的方法,该化合物对于一级胺类化合物有极高的重氮转移反应活性和选择性.请回答下列问题:
(氟磺酰基叠氮)的方法,该化合物对于一级胺类化合物有极高的重氮转移反应活性和选择性.请回答下列问题:
(1)基态硫的价电子排布为_________________,氟的最高能级中电子云的形状为_______________.
(2)![]() 中四种元素的第一电离能由大到小的顺序为___________________.
中四种元素的第一电离能由大到小的顺序为___________________.
(3)以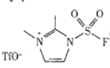 和NaN3为原料在一定条件下可合成
和NaN3为原料在一定条件下可合成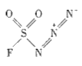 (氟磺酰基叠氮).
(氟磺酰基叠氮).
①NaN3中阴离子的中心氮原子的杂化方式为__________________.
② 中不存在_______________(填字母).
中不存在_______________(填字母).
A.极性键B.非极性键C.离子键D.金属键E.σ键F.π键
(4)H-S-C≡N和H-N=C=S均为叠氮酸(HN3)的等电子体,二者的沸点: H-S-C≡N<H-N=C=S,其原因是_________________,H-S-C≡N、H-N=C=S晶体中,有一种采用分子密堆积,即配位数为12,该物质是_____________________(填结构式).
(5)NaN3晶体的晶胞结构如图所示.
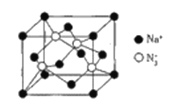
①晶体中,每个Na+周围与它距离最近且相等的Na+共有_____________个
②设阿伏加德罗常数的值为NA,晶胞参数为apm,则NaN3晶体的密度为_____________g·cm-3(列出计算式).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com