
【题目】下列化学用语使用正确的是
A.次氯酸的结构式:H–Cl–OB.氮气的电子式:![]()
C.甲烷分子的比例模型为![]() D.乙烯的结构简式:CH2CH2
D.乙烯的结构简式:CH2CH2
【答案】C
【解析】
A.次氯酸分子中,H原子形成1个共价键即可成2电子稳定体系,O原子最外层有6个电子,形成2个共价键可形成8电子稳定体系,Cl原子最外层有7个电子,形成1个共价键可形成8电子稳定体系,故次氯酸的结构式:H–O–Cl,A项错误;
B.书写主族元素的电子式,要把最外层电子一一表示出来,题中氮气的电子式未将N原子的最外层电子一一表示出来,氮气的电子式应为:![]() ,B项错误;
,B项错误;
C.比例模型用于表示分子中各原子的相对大小和结合顺序,甲烷分子呈正四面体结构,且碳原子半径比氢原子大,所以比例模型为![]() ,C项正确;
,C项正确;
D.结构简式是把结构式中的碳氢单键省略之后的一种简略表达形式,应表现该物质中的官能团,乙烯的结构简式中碳氢单键可以省略,碳碳双键不可以省略,故乙烯的结构简式:CH2=CH2,D项错误;
答案选C。


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】(1)键线式![]() 表示的分子式____________名称是_______
表示的分子式____________名称是_______
(2) 中含有的官能团的名称为_______
中含有的官能团的名称为_______
(3)戊烷的某种同分异构体只有一种一氯代物,试书写它的结构简式______
(4)某炔烃和氢气充分加成生成2,5-二甲基己烷,该炔烃的结构简式是____________
(5)某芳香烃结构为![]() 。它的分子式为________,一氯代物有________种。
。它的分子式为________,一氯代物有________种。
(6)分子式为C6H12的某烃的所有碳原子都在同一平面上,则该烃的结构简式为_________,若分子式为C4H6的某烃中所有的碳原子都在同一条直线上,则该烃的结构简式为__________。
(7)分子式为C8H10的芳香烃,苯环上的一氯代物只有一种,该芳香烃的结构简式是______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,装置在常温下工作(溶液体积变化忽略不计).闭合K,灯泡发光.下列叙述中不正确的是( )
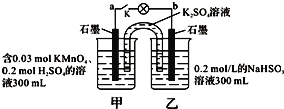
A.当电路中有1.204×1022个电子转移时,乙烧杯中溶液的H+浓度约为0.1mol/L
B.电池工作时,盐桥中的K+移向甲烧杯,外电路的电子方向是从b到a
C.电池工作时,甲烧杯发生的反应为MnO4- + 3e- + 4H+ = MnO2 + 2H2O
D.乙池中的氧化产物为SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列有机分子的模型回答问题
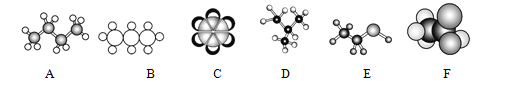
(1)写出A、B、C、D的结构简式:
A:_____ B、_____ C、__________ D、________
(2)E、F中官能团的名称分别是:_________ _________
(3)用“同分异构体”“同系物”填空:
A与B的关系是互为:__________ A与D的关系是互为:_________
(4)A的一氯代物有_____种,B的二氯代物有_____种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、N、Q、P为元素周期表前四周期的7种元素。其中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量最高的元素,M的内层电子数是最外层电子数的9倍,N的原子序数比M小1, Q在元素周期表的各元素中电负性最大。P元素的第三电子层处于全充满状态,第四电子层只有一个电子。请回答下列问题:
(1)基态X的外围电子电子排布图为_________ 。P元素属于__________ 区元素,
(2)XZ2分子的空间构型是______,YZ2分子中Y的杂化轨道类型为_____,相同条件下两者在水中的溶解度较大的是_____(写分子式),理由是_____。
(3)元素M与元素Q形成晶体中,M离子与Q离子的配位数之比为__________
(4)P单质形成的晶体中,P原子采取的堆积方式为_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组分子中,都由极性键构成的极性分子的一组是
A. C3H6和CO2 B. CCl4和H2S C. H2O和NH3 D. H2O2和CS2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向a L密闭容器中加入1mol X气体和2 mol Y气体,发生如下反应:X(g)+2Y(g)![]()
![]() 2Z(g)此反应达到平衡的标志是( )
2Z(g)此反应达到平衡的标志是( )
A. 容器内压强不随时间变化
B. 容器内气体的密度不随时间变化
C. 容器内X、Y、Z的浓度之比为1︰2︰2
D. 单位时间消耗0.1mol X同时生成0.2mol Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,Y和Z位于同一主族。m、n、p均为由这些元素组成的二元化合物,甲、乙、丙为其中三种元素对应的单质,丙为淡黄色固体,易溶在XZ2中,n是一种二元弱酸。上述物质的转化关系如图所示(反应条件省略)。下列说法正确的是
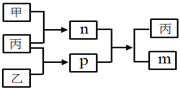
A. 原子半径:W<X<Y B. 非金属性:Y>Z>X
C. Y与Z组成的化合物一定有漂白性 D. W与X组成的化合物中只有极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂电池由于能量密度大逐渐取代锌电池。常用锂电池的正极材料为磷酸亚铁锂(LiFe-PO4),可采用FeCl3、NH4H2PO4、LiCl和苯胺等原料制备。回答下列问题:
(1)Fe基态原子核外电子排布式为___。
(2)已知Li2O是离子晶体,其晶格能的Born-Haber循环如图所示。
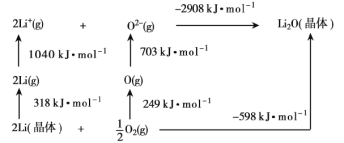
如图可知,Li原子的第一电离能为___kJ·mol-1,O=O键键能为___kJ·mol-1,Li2O晶格能为__kJ·moL-1。
(3)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为___,其中Fe的配位数为___。
(4)NH4H2PO4中,P的杂化轨道类型为___。
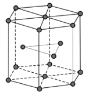
(5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为___。六棱柱底边边长为a cm,高为ccm,阿伏加德罗常数的值为NA,Zn的密度为___g·cm-3(列出计算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com